730. Perché si usa l'acqua per raffreddare alcuni meccanismi?
L'acqua è fantastica calore specifico, che contribuisce a una buona dissipazione del calore dal meccanismo.
731. In quale caso si dovrebbe spendere più energia: per riscaldare un litro d'acqua di 1 °C o per riscaldare cento grammi d'acqua di 1 °C?
Per riscaldare un litro d'acqua, poiché maggiore è la massa, più energia deve essere spesa.
732. Forchette di cupronichel e argento della stessa massa venivano immerse in acqua calda. Ricevono la stessa quantità di calore dall'acqua?
Una forchetta in cupronichel riceverà più calore, perché il calore specifico del cupronichel è maggiore di quello dell'argento.
733. Un pezzo di piombo e un pezzo di ghisa della stessa massa furono colpiti tre volte con una mazza. Quale parte è diventata più calda?
Il piombo si riscalda di più perché la sua capacità termica specifica è inferiore alla ghisa e per riscaldare il piombo è necessaria meno energia.
734. Una fiasca contiene acqua, l'altra contiene kerosene della stessa massa e temperatura. In ogni pallone veniva gettato un cubo di ferro ugualmente riscaldato. Cosa si scalderà di più alta temperatura- acqua o cherosene?
Cherosene.
735. Perché le fluttuazioni di temperatura sono meno brusche in inverno e in estate nelle città in riva al mare che nelle città situate nell'entroterra?
L'acqua si riscalda e si raffredda più lentamente dell'aria. In inverno si raffredda e sposta le masse d'aria calda sulla terraferma, rendendo più caldo il clima sulla costa.
736. Calore specifico alluminio è 920 J/kg °C. Cosa significa questo?
Ciò significa che occorrono 920 J per riscaldare 1 kg di alluminio di 1 °C.
737. Barre di alluminio e di rame della stessa massa di 1 kg sono raffreddate di 1 °C. Quanto cambierà Energia interna ogni barra? Quale barra cambierà di più e di quanto?
738. Quale quantità di calore è necessaria per riscaldare un chilogrammo di billetta di ferro di 45 °C?
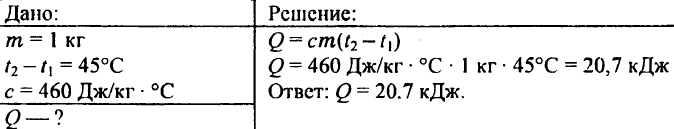
739. Quanto calore è necessario per riscaldare 0,25 kg di acqua da 30°C a 50°C?

740. Come cambierà l'energia interna di due litri di acqua riscaldata di 5 °C?

741. Quanto calore è necessario per riscaldare 5 g di acqua da 20 °C a 30 °C?
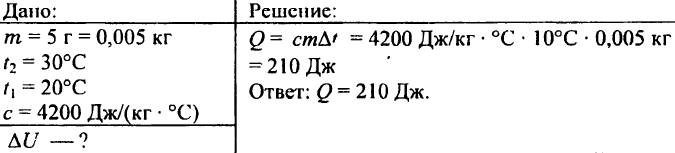
742. Quale quantità di calore è necessaria per riscaldare di 72 °C una sfera di alluminio del peso di 0,03 kg?
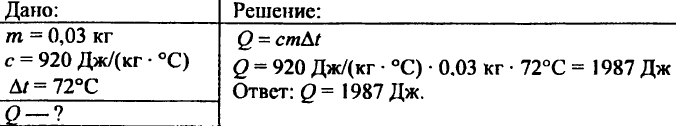
743. Calcola la quantità di calore necessaria per riscaldare 15 kg di rame di 80 °C.
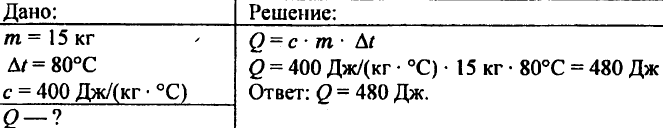
744. Calcola la quantità di calore necessaria per riscaldare 5 kg di rame da 10 °C a 200 °C.

745. Qual è la quantità di calore necessaria per riscaldare 0,2 kg di acqua da 15 °C a 20 °C?

746. L'acqua del peso di 0,3 kg si è raffreddata di 20 °C. Di quanto si riduce l'energia interna dell'acqua?

747. Quanto calore è necessario per riscaldare 0,4 kg di acqua a una temperatura di 20 °C a una temperatura di 30 °C?

748. Quanto calore viene speso per riscaldare 2,5 kg di acqua di 20 °C?
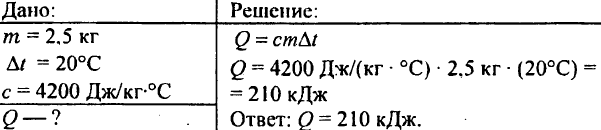
749. Quanto calore è stato rilasciato quando 250 g di acqua si sono raffreddati da 90 °C a 40 °C?

750. Quale quantità di calore è necessaria per riscaldare 0,015 litri di acqua di 1 °C?

751. Calcola la quantità di calore necessaria per riscaldare di 10 °C uno stagno con un volume di 300 m3?

752. Quanto calore deve essere ceduto ad 1 kg d'acqua per innalzarne la temperatura da 30°C a 40°C?
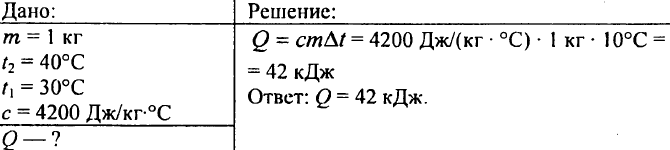
753. L'acqua con un volume di 10 litri si è raffreddata da una temperatura di 100 °C a una temperatura di 40 °C. Quanto calore viene rilasciato in questo caso?

754. Calcola la quantità di calore necessaria per riscaldare 1 m3 di sabbia di 60 °C.

755. Volume d'aria 60 m3, capacità termica specifica 1000 J/kg °C, densità dell'aria 1,29 kg/m3. Quanto calore è necessario per portarlo a 22°C?
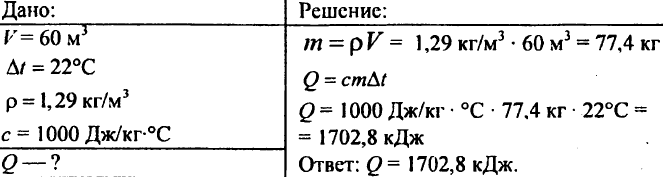
756. L'acqua è stata riscaldata di 10 ° C, spendendo 4,20 103 J di calore. Determina la quantità di acqua.

757. L'acqua del peso di 0,5 kg riportava 20,95 kJ di calore. Qual era la temperatura dell'acqua se la temperatura iniziale dell'acqua era 20°C?
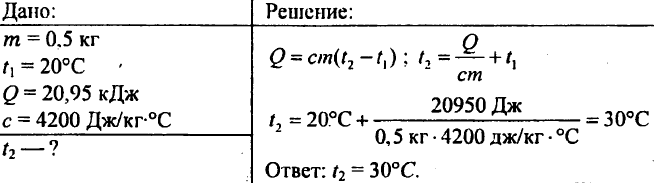
758. In una pentola di rame del peso di 2,5 kg si versano 8 kg di acqua a 10 °C. Quanto calore è necessario per portare a ebollizione l'acqua in una casseruola?

759. In un mestolo di rame del peso di g 300 si versa un litro d'acqua alla temperatura di 15 °C Quanto calore occorre per riscaldare l'acqua nel mestolo di 85 °C?

760. Si mette in acqua un pezzo di granito riscaldato del peso di 3 kg. Il granito trasferisce 12,6 kJ di calore all'acqua, raffreddandosi di 10 °C. Qual è il calore specifico della pietra?
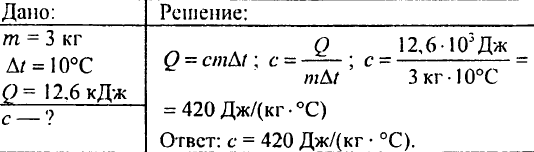
761. A 5 kg di acqua a 12°C è stata aggiunta acqua calda a 50°C, ottenendo una miscela con una temperatura di 30°C. Quanta acqua è stata aggiunta?

762. Acqua a 20°C è stata aggiunta a 3 litri di acqua a 60°C per ottenere acqua a 40°C. Quanta acqua è stata aggiunta?

763. Quale sarà la temperatura dell'impasto se si impastano 600 g di acqua a 80 °C con 200 g di acqua a 20 °C?

764. Un litro d'acqua a 90°C fu versato in acqua a 10°C, e la temperatura dell'acqua divenne 60°C. Quanto costava acqua fredda?
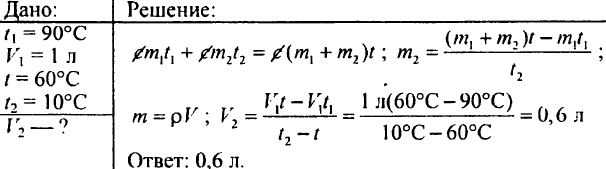
765. Determina quanta acqua calda riscaldata a 60°C si deve versare in un recipiente se il recipiente contiene già 20 litri di acqua fredda alla temperatura di 15°C; la temperatura della miscela deve essere di 40 °C.
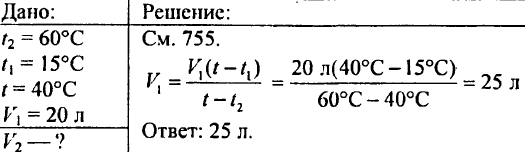
766. Determina quanto calore occorre per riscaldare di 20 °C 425 g d'acqua.

767. Di quanti gradi si scalderanno 5 kg di acqua se l'acqua riceve 167,2 kJ?

768. Quanto calore è necessario per portare m grammi d'acqua a una temperatura t1 a una temperatura t2?
769. In un calorimetro si versano 2 kg di acqua alla temperatura di 15 °C. A quale temperatura si riscalda l'acqua del calorimetro se vi si cala dentro un peso di ottone di 500 g riscaldato a 100 °C? La capacità termica specifica dell'ottone è di 0,37 kJ/(kg °C).

770. Ci sono pezzi di rame, stagno e alluminio dello stesso volume. Quale di questi pezzi ha la capacità termica più grande e quale quella più piccola?

771. Nel calorimetro sono stati versati 450 g di acqua, la cui temperatura è di 20 °C. Immergendo in quest'acqua 200 g di limatura di ferro riscaldata a 100°C, la temperatura dell'acqua diventava di 24°C. Determina la capacità termica specifica della segatura.

772. Un calorimetro di rame del peso di 100 g contiene 738 g di acqua, la cui temperatura è di 15 °C. In questo calorimetro sono stati calati 200 g di rame ad una temperatura di 100 °C, dopodiché la temperatura del calorimetro è salita a 17 °C. Qual è la capacità termica specifica del rame?

773. Una sfera d'acciaio del peso di 10 g viene estratta dal forno e calata in acqua alla temperatura di 10 °C. La temperatura dell'acqua è salita a 25°C. Qual era la temperatura della pallina nel forno se la massa d'acqua è 50 g? La capacità termica specifica dell'acciaio è di 0,5 kJ/(kg °C).

777. 50 g di acqua a 19 °C vengono versati in acqua del peso di 150 g alla temperatura di 35 °C. Qual è la temperatura della miscela?

778. Acqua del peso di 5 kg a 90 °C fu versata in un bollitore di ghisa del peso di 2 kg alla temperatura di 10 °C. Qual era la temperatura dell'acqua?

779. Uno scalpello d'acciaio del peso di 2 kg fu riscaldato alla temperatura di 800 °C e poi calato in un recipiente contenente 15 litri di acqua alla temperatura di 10 °C. A quale temperatura verrà riscaldata l'acqua nel recipiente?

(Indicazione. Per risolvere questo problema, è necessario creare un'equazione in cui la temperatura desiderata dell'acqua nel recipiente dopo che il cutter è stato abbassato sia presa come sconosciuta.)
780. Che temperatura raggiungerà l'acqua se mescoli 0,02 kg di acqua a 15 °C, 0,03 kg di acqua a 25 °C e 0,01 kg di acqua a 60 °C?
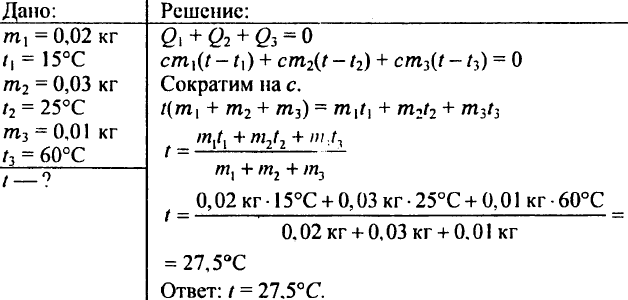
781. Il riscaldamento di una classe ben ventilata richiede una quantità di calore di 4,19 MJ all'ora. L'acqua entra nei radiatori del riscaldamento a 80°C ed esce a 72°C. Quanta acqua dovrebbe essere fornita ai radiatori ogni ora?

782. Piombo del peso di 0,1 kg alla temperatura di 100 °C è stato immerso in un calorimetro di alluminio del peso di 0,04 kg contenente 0,24 kg di acqua alla temperatura di 15 °C. Successivamente, nel calorimetro è stata stabilita la temperatura di 16 °C. Qual è la capacità termica specifica del piombo?

Quando discutiamo dei modi per riscaldare una casa, delle opzioni per ridurre la dispersione di calore, dobbiamo capire cos'è il calore, in quali unità viene misurato, come viene trasmesso e come viene perso. Questa pagina fornirà le informazioni di base del corso di fisica necessarie per considerare tutte le questioni di cui sopra.
Il calore è un modo per trasferire energia
L'energia che un corpo riceve o perde nel processo di scambio termico con l'ambiente è chiamata quantità di calore o semplicemente calore.
In senso stretto, il calore è uno dei modi per trasferire energia e solo la quantità di energia trasferita al sistema ha un significato fisico, ma la parola "calore" è inclusa in concetti scientifici consolidati come flusso di calore, capacità termica , calore di transizione di fase, calore di reazione chimica, conduttività termica, ecc. Pertanto, laddove tale uso di parole non sia fuorviante, i concetti di "calore" e "quantità di calore" sono sinonimi. Tuttavia, questi termini possono essere utilizzati solo se forniti definizione precisa, e in nessun caso la "quantità di calore" può essere attribuita al numero di concetti iniziali che non richiedono definizione. Per evitare errori, il concetto di "calore" dovrebbe essere inteso proprio come il metodo di trasferimento di energia, e la quantità di energia trasferita con questo metodo è indicata dal concetto di "quantità di calore". Si raccomanda di evitare il termine "energia termica".
Il calore è la parte cinetica dell'energia interna di una sostanza, determinata dall'intenso movimento caotico delle molecole e degli atomi che compongono questa sostanza. La temperatura è una misura dell'intensità del movimento molecolare. La quantità di calore posseduta da un corpo a una data temperatura dipende dalla sua massa; ad esempio, a parità di temperatura, è contenuto più calore in una tazza d'acqua grande che in una piccola, e in un secchio d'acqua fredda può essercene di più che in una tazza d'acqua calda (sebbene la temperatura dell'acqua in il secchio è più basso).
Il calore è una forma di energia e quindi deve essere misurato in unità di energia. IN sistema internazionale L'unità di misura dell'energia nel SI è il joule (J). È inoltre consentito utilizzare un'unità fuori sistema della quantità di calore - calorie: una caloria internazionale è 4,1868 J.
Trasferimento di calore e trasferimento di calore
Il trasferimento di calore è il processo di trasferimento del calore all'interno di un corpo o da un corpo all'altro, a causa delle differenze di temperatura. L'intensità del trasferimento di calore dipende dalle proprietà della sostanza, dalla differenza di temperatura e obbedisce alle leggi della natura stabilite sperimentalmente. Per creare sistemi di riscaldamento o raffreddamento efficienti, vari motori, centrali elettriche, sistemi di isolamento termico, è necessario conoscere i principi del trasferimento di calore. In alcuni casi, il trasferimento di calore è indesiderabile (isolamento termico di forni fusori, astronavi ecc.), mentre in altri dovrebbe essere il più grande possibile (caldaie a vapore, scambiatori di calore, utensili da cucina). Esistono tre tipi principali di trasferimento di calore: conduzione, convezione e trasferimento di calore radiante.
Conduttività termica
Se c'è una differenza di temperatura all'interno del corpo, allora l'energia termica passa dalla sua parte più calda a quella più fredda. Questo tipo di trasferimento di calore, dovuto a movimenti termici e collisioni di molecole, è chiamato conducibilità termica. La conduttività termica dell'asta è stimata dal valore flusso di calore, che dipende dal coefficiente di conducibilità termica, dall'area della sezione trasversale attraverso la quale viene trasferito il calore e dal gradiente di temperatura (il rapporto tra la differenza di temperatura alle estremità dell'asta e la distanza tra loro). L'unità di misura del flusso di calore è il watt.
CONDUCIBILITÀ TERMICA DI ALCUNE SOSTANZE E MATERIALI
Sostanze e materiali Conduttività termica, W/(m^2*K)
Metalli
Alluminio ___________________205
Bronzo _____________________105
Tungsteno ___________________159
Ferro ___________________________________67
Rame _______________________389
Nichel ______________________58
Piombo ______________________35
Zinco _______________________113
Altri materiali
Amianto _______________________0.08
Calcestruzzo ________________________0.59
Aria _______________________0.024
Piumino (sciolto) ______0.008
Legno (noce) ________________0.209
Segatura _______________________0.059
Gomma (spugnosa) ____________0.038
Vetro _______________________0.75
Convezione
La convezione è il trasferimento di calore dovuto al movimento di masse d'aria o di liquido. Quando il calore viene applicato a un liquido o gas, l'intensità del movimento delle molecole aumenta e, di conseguenza, la pressione aumenta. Se un liquido o un gas non ha un volume limitato, allora si espandono; la densità locale del liquido (gas) diminuisce e, a causa delle forze di galleggiamento (di Archimede), la parte riscaldata del mezzo si sposta verso l'alto (motivo per cui l'aria calda nella stanza sale dalle batterie al soffitto). In casi semplici di flusso di fluido attraverso un tubo o flusso attorno a una superficie piana, il coefficiente di trasferimento termico convettivo può essere calcolato teoricamente. Tuttavia, non è stato ancora possibile trovare una soluzione analitica al problema della convezione per un flusso turbolento di un mezzo.
radiazione termica
Il terzo tipo di trasferimento di calore - trasferimento di calore radiante - differisce dalla conduzione e dalla convezione del calore in quanto il calore in questo caso può essere trasferito attraverso il vuoto. La sua somiglianza con altri metodi di trasferimento del calore è che è anche dovuta alla differenza di temperatura. La radiazione termica è uno dei tipi di radiazione elettromagnetica.
Il Sole è un potente emettitore di energia termica; riscalda la Terra anche a una distanza di 150 milioni di km. L'intensità della radiazione solare è di circa 1,37 W/m2.
La velocità di trasferimento del calore per conduzione e convezione è proporzionale alla temperatura e il flusso di calore radiante è proporzionale alla quarta potenza della temperatura.
Capacità termica
Sostanze diverse hanno capacità diverse di immagazzinare calore; dipende dalla loro struttura molecolare e densità. La quantità di calore necessaria per aumentare di un grado (1 ° C o 1 K) la temperatura di un'unità di massa di una sostanza è chiamata capacità termica specifica. La capacità termica è misurata in J/(kg K).
Solitamente distinguere la capacità termica a volume costante ( CV) e capacità termica a pressione costante (C P), se durante il processo di riscaldamento si mantengono costanti rispettivamente il volume del corpo o la pressione. Ad esempio, per riscaldare un grammo d'aria in un pallone di 1 K, è necessario più calore che riscaldarlo allo stesso modo in un recipiente sigillato con pareti rigide, poiché parte dell'energia impartita al pallone viene spesa per espandere il aria, e non riscaldandola. Se riscaldato a pressione costante, parte del calore va alla produzione del lavoro di espansione del corpo e parte - per aumentare la sua energia interna, mentre se riscaldato a volume costante, tutto il calore viene speso per aumentare l'energia interna; a causa di ciò C R sempre più di CV. Per liquidi e solidi, la differenza tra C R E CV relativamente piccolo.
macchine termiche
I motori termici sono dispositivi che convertono il calore in lavoro utile. Esempi di tali macchine sono compressori, turbine, motori a vapore, benzina e jet. Uno dei motori termici più famosi è la turbina a vapore utilizzata nelle moderne centrali termiche. Uno schema semplificato di una tale centrale elettrica è mostrato nella Figura 1.

Riso. 1. Schema semplificato di una centrale elettrica a turbina a vapore funzionante a combustibili fossili.
Il fluido di lavoro - l'acqua - viene convertito in vapore surriscaldato in una caldaia a vapore riscaldata dalla combustione di combustibili fossili (carbone, petrolio o gas naturale). Vapore alta pressione ruota l'albero di una turbina a vapore, che aziona un generatore che genera elettricità. Il vapore di scarico condensa quando viene raffreddato dall'acqua corrente, che assorbe parte del calore. Successivamente, l'acqua viene immessa nella torre di raffreddamento (torre di raffreddamento), da dove parte del calore viene rilasciato nell'atmosfera. La condensa viene pompata nuovamente nella caldaia a vapore e l'intero ciclo viene ripetuto.
Un altro esempio di motore termico è un frigorifero domestico, il cui schema è mostrato in Fig. 2.

Nei frigoriferi e nei condizionatori d'aria domestici, l'energia viene fornita dall'esterno per fornirla. Il compressore aumenta la temperatura e la pressione della sostanza di lavoro del frigorifero: freon, ammoniaca o anidride carbonica. Il gas surriscaldato viene immesso nel condensatore, dove si raffredda e condensa cedendo calore ambiente. Il liquido che esce dagli ugelli del condensatore passa attraverso la valvola di strozzamento nell'evaporatore e parte di esso evapora, accompagnato da un forte calo di temperatura. L'evaporatore prende calore dalla camera del frigorifero, che riscalda il fluido di lavoro negli ugelli; questo liquido viene fornito dal compressore al condensatore e il ciclo si ripete nuovamente.
L'energia interna del corpo può cambiare a causa del lavoro di forze esterne. Per caratterizzare la variazione di energia interna durante il trasferimento di calore, viene introdotta una quantità chiamata quantità di calore e indicata con Q.
Nel sistema internazionale l'unità di misura della quantità di calore, oltre che di lavoro ed energia, è il joule: = = = 1 J.
In pratica, a volte viene utilizzata un'unità fuori sistema della quantità di calore: una caloria. 1 cal. = 4,2 J.
Va notato che il termine "quantità di calore" è infelice. È stato introdotto in un momento in cui si credeva che i corpi contenessero un liquido calorico senza peso e sfuggente. Il processo di trasferimento del calore presumibilmente consiste nel fatto che il calorico, riversandosi da un corpo all'altro, porta con sé una certa quantità di calore. Ora, conoscendo le basi della teoria cinetico-molecolare della struttura della materia, capiamo che non c'è calorico nei corpi, il meccanismo per cambiare l'energia interna di un corpo è diverso. Tuttavia, il potere della tradizione è grande e continuiamo a usare il termine, introdotto sulla base di idee errate sulla natura del calore. Allo stesso tempo, comprendendo la natura del trasferimento di calore, non si dovrebbero ignorare completamente le idee sbagliate al riguardo. Al contrario, tracciando un'analogia tra il flusso di calore e il flusso di un ipotetico liquido di calorico, la quantità di calore e la quantità di calorico, è possibile, nella risoluzione di alcune classi di problemi, visualizzare i processi in atto e risolvere correttamente i problemi. Alla fine, le equazioni corrette che descrivono i processi di trasferimento del calore sono state ottenute un tempo sulla base di idee errate sul calorico come vettore di calore.
Consideriamo più in dettaglio i processi che possono verificarsi a seguito del trasferimento di calore.
Versa dell'acqua in una provetta e chiudila con un tappo di sughero. Appendi la provetta a un'asta fissata su un treppiede e porta una fiamma libera sotto di essa. Dalla fiamma la provetta riceve una certa quantità di calore e la temperatura del liquido in essa contenuto sale. All'aumentare della temperatura, l'energia interna del liquido aumenta. C'è un processo intensivo della sua vaporizzazione. I vapori liquidi in espansione svolgono un lavoro meccanico per spingere il tappo fuori dal tubo.
Conduciamo un altro esperimento con un modello di cannone ricavato da un pezzo di tubo di ottone montato su un carrello. Da un lato, il tubo è ben chiuso con un tappo di ebanite, attraverso il quale viene fatto passare uno spillo. I fili sono saldati al perno e al tubo, terminando in terminali che possono essere alimentati dalla rete di illuminazione. Il modello a pistola è quindi una specie di bollitore elettrico.
 |
Versa dell'acqua nella canna del cannone e chiudi il tubo con un tappo di gomma. Collegare la pistola a una fonte di alimentazione. Elettricità, passando attraverso l'acqua, la riscalda. L'acqua bolle, il che porta alla sua intensa vaporizzazione. La pressione del vapore acqueo aumenta e, infine, fanno il lavoro di spingere il tappo fuori dalla canna del fucile.
La pistola, a causa del rinculo, rotola indietro nella direzione opposta al lancio del tappo.
Entrambe le esperienze sono accomunate dalle seguenti circostanze. Nel processo di riscaldamento del liquido in vari modi, la temperatura del liquido e, di conseguenza, la sua energia interna sono aumentate. Affinché il liquido bolle ed evapori intensamente, era necessario continuare a riscaldarlo.
I vapori del liquido, a causa della loro energia interna, hanno svolto un lavoro meccanico.
 |
Indaghiamo sulla dipendenza della quantità di calore necessaria per riscaldare il corpo dalla sua massa, dalle variazioni di temperatura e dal tipo di sostanza. Per studiare queste dipendenze, useremo acqua e olio. (Per misurare la temperatura nell'esperimento, viene utilizzato un termometro elettrico, costituito da una termocoppia collegata a un galvanometro a specchio. Una giunzione della termocoppia viene abbassata in un recipiente con acqua fredda per garantire che la sua temperatura sia costante. L'altra giunzione della termocoppia misura la temperatura del liquido in esame).
L'esperienza si compone di tre serie. Nella prima serie, per una massa costante di un particolare liquido (nel nostro caso l'acqua), si studia la dipendenza della quantità di calore necessaria per riscaldarlo dalle variazioni di temperatura. La quantità di calore ricevuta dal liquido dal riscaldatore (stufa elettrica) sarà giudicata dal tempo di riscaldamento, supponendo che esista una relazione direttamente proporzionale tra di loro. Affinché il risultato dell'esperimento corrisponda a questa ipotesi, è necessario garantire un flusso costante di calore dalla stufa elettrica al corpo riscaldato. Per fare ciò, la stufa elettrica è stata preventivamente collegata alla rete, in modo che all'inizio dell'esperimento la temperatura della sua superficie smettesse di cambiare. Per un riscaldamento più uniforme del liquido durante l'esperimento, lo mescoleremo con l'aiuto della termocoppia stessa. Registreremo le letture del termometro a intervalli regolari fino a quando il punto luminoso raggiunge il bordo della scala.
Concludiamo: esiste una relazione proporzionale diretta tra la quantità di calore necessaria per riscaldare un corpo e una variazione della sua temperatura.
Nella seconda serie di esperimenti confronteremo la quantità di calore necessaria per riscaldare gli stessi liquidi di masse diverse quando la loro temperatura cambia della stessa quantità.
Per comodità di confronto dei valori ottenuti, la massa d'acqua per il secondo esperimento sarà presa due volte inferiore rispetto al primo esperimento.
Ancora una volta, registreremo le letture del termometro a intervalli regolari.
Confrontando i risultati del primo e del secondo esperimento, possiamo trarre le seguenti conclusioni.
Nella terza serie di esperimenti, confronteremo le quantità di calore richieste per riscaldare masse uguali di liquidi diversi quando la loro temperatura cambia della stessa quantità.
Scalderemo l'olio su una stufa elettrica, la cui massa è uguale alla massa dell'acqua nel primo esperimento. Registreremo le letture del termometro a intervalli regolari.
Il risultato dell'esperimento conferma la conclusione che la quantità di calore necessaria per riscaldare il corpo è direttamente proporzionale al cambiamento della sua temperatura e, inoltre, indica la dipendenza di questa quantità di calore dal tipo di sostanza.
Poiché nell'esperimento è stato utilizzato olio, la cui densità è inferiore alla densità dell'acqua, ed è stata necessaria una quantità minore di calore per riscaldare l'olio a una certa temperatura rispetto al riscaldamento dell'acqua, si può presumere che la quantità di calore necessario per riscaldare il corpo dipende dalla sua densità.
Per verificare questa ipotesi, riscalderemo simultaneamente masse identiche di acqua, paraffina e rame su un riscaldatore di potenza costante.
Dopo lo stesso tempo, la temperatura del rame è circa 10 volte e la paraffina è circa 2 volte superiore alla temperatura dell'acqua.
Ma il rame ha una densità maggiore e meno paraffinica dell'acqua.
L'esperienza mostra che la grandezza che caratterizza la velocità di variazione della temperatura delle sostanze di cui sono fatti i corpi coinvolti nello scambio termico non è la densità. Questa quantità è chiamata la capacità termica specifica della sostanza ed è indicata dalla lettera c.
 |
Confrontare le capacità termiche specifiche varie sostanzeè un dispositivo speciale. Il dispositivo è costituito da rack in cui sono fissate una sottile lastra di paraffina e una barra con aste passate attraverso di essa. I cilindri in alluminio, acciaio e ottone sono rinforzati alle estremità delle aste massa uguale.
Riscaldiamo i cilindri alla stessa temperatura immergendoli in un recipiente d'acqua posto su una stufa elettrica calda. Fissiamo i cilindri caldi sulle cremagliere e liberiamoli dai dispositivi di fissaggio. I cilindri toccano contemporaneamente la lastra di paraffina e, sciogliendo la paraffina, iniziano ad affondarvi. La profondità di immersione di cilindri della stessa massa in una lastra di paraffina, quando la loro temperatura cambia della stessa quantità, risulta essere diversa.
L'esperienza mostra che le capacità termiche specifiche di alluminio, acciaio e ottone sono diverse.
Dopo aver fatto gli esperimenti corrispondenti con la fusione solidi, vaporizzazione di liquidi, combustione di combustibile, si ottengono le seguenti dipendenze quantitative.
Per ottenere unità di quantità specifiche, devono essere espresse dalle formule corrispondenti e le unità di calore - 1 J, massa - 1 kg e per calore specifico - e 1 K devono essere sostituite nelle espressioni risultanti.
Otteniamo unità: capacità termica specifica - 1 J / kg K, altri calori specifici: 1 J / kg.
Obiettivo di apprendimento: Introdurre i concetti di quantità di calore e capacità termica specifica.
Obiettivo di sviluppo: coltivare la consapevolezza; impara a pensare, trarre conclusioni.
1. Aggiornamento dell'argomento
2. Spiegazione del nuovo materiale. 50 min.
Sai già che l'energia interna di un corpo può cambiare sia compiendo lavoro che cedendo calore (senza compiere lavoro).
L'energia che un corpo riceve o perde durante il trasferimento di calore è chiamata quantità di calore. (annotazione del taccuino)
Ciò significa che anche le unità di misura della quantità di calore sono i Joule ( J).
Conduciamo un esperimento: due bicchieri in uno da 300 g di acqua e nell'altro 150 g e un cilindro di ferro del peso di 150 g Entrambi i bicchieri sono posti sulla stessa piastrella. Dopo un po ', i termometri mostreranno che l'acqua nella nave in cui si trova il corpo si riscalda più velocemente.
Ciò significa che è necessario meno calore per riscaldare 150 g di ferro che per riscaldare 150 g di acqua.
La quantità di calore trasferita al corpo dipende dal tipo di sostanza di cui è composto il corpo. (annotazione del taccuino)
Proponiamo la domanda: è la stessa quantità di calore necessaria per riscaldare alla stessa temperatura corpi di uguale massa, ma costituiti da diverse sostanze?
Conduciamo un esperimento con il dispositivo Tyndall per determinare la capacità termica specifica.
Concludiamo: corpi di sostanze diverse, ma della stessa massa, emanano quando si raffreddano e richiedono quando si riscaldano dello stesso numero di gradi importo diverso calore.
Traiamo conclusioni:
1. Per riscaldare alla stessa temperatura corpi di massa uguale, costituiti da sostanze diverse, è necessaria una diversa quantità di calore.
2. Corpi di massa uguale, costituiti da sostanze diverse e riscaldati alla stessa temperatura. Se raffreddate dello stesso numero di gradi, emanano una diversa quantità di calore.
Facciamo la conclusione che la quantità di calore necessaria per aumentare di un grado l'unità di massa di diverse sostanze sarà diversa.
Diamo la definizione di capacità termica specifica.
La grandezza fisica, numericamente uguale alla quantità di calore che deve essere trasferita ad un corpo di massa 1 kg affinché la sua temperatura cambi di 1 grado, è detta calore specifico della sostanza.
Introduciamo l'unità di misura del calore specifico: 1J/kg*grado.
Il significato fisico del termine : la capacità termica specifica mostra quanto cambia l'energia interna di 1 g (kg.) Di una sostanza quando viene riscaldata o raffreddata di 1 grado.
Considera la tabella delle capacità termiche specifiche di alcune sostanze.
Risolviamo il problema analiticamente
Quanto calore è necessario per riscaldare un bicchiere d'acqua (200 g) da 20 0 a 70 0 C.
Per riscaldare 1 g per 1 g Richiesto - 4,2 J.
E per riscaldare 200 g per 1 g, ne occorrono altri 200 - 200 * 4,2 J.
E per riscaldare 200 g di (70 0 -20 0) ci vorrà un altro (70-20) in più - 200 * (70-20) * 4,2 J
Sostituendo i dati, otteniamo Q = 200 * 50 * 4,2 J = 42000 J.
Scriviamo la formula risultante in termini di quantità corrispondenti
4. Cosa determina la quantità di calore ricevuta dal corpo quando riscaldato?
Si noti che la quantità di calore necessaria per riscaldare un corpo è proporzionale alla massa del corpo e al cambiamento della sua temperatura.,
Ci sono due cilindri della stessa massa: ferro e ottone. È necessaria la stessa quantità di calore per riscaldarli dello stesso numero di gradi? Perché?
Quanto calore è necessario per riscaldare 250 g di acqua da 20° a 60° C.
Qual è la relazione tra calorie e joule?
Una caloria è la quantità di calore necessaria per aumentare di 1 grado la temperatura di 1 grammo di acqua.
1 cal = 4,19=4,2 J
1kcal=1000cal
1kcal=4190J=4200J
3. Risoluzione dei problemi. 28 min.
Se cilindri di piombo, stagno e acciaio riscaldati in acqua bollente con una massa di 1 kg vengono posti sul ghiaccio, si raffredderanno e parte del ghiaccio sotto di essi si scioglierà. Come cambierà l'energia interna dei cilindri? Sotto quale dei cilindri si scioglierà più ghiaccio, sotto quale - meno?
Una pietra riscaldata con una massa di 5 kg. Raffreddandosi in acqua di 1 grado, le trasferisce 2,1 kJ di energia. Qual è la capacità termica specifica della pietra
Durante l'indurimento di uno scalpello, è stato prima riscaldato a 650 0, quindi abbassato in olio, dove si è raffreddato a 50 0 C. Quale quantità di calore è stata rilasciata se la sua massa era di 500 g.
Quanto calore è stato speso per riscaldare da 20 0 a 1220 0 C. una billetta d'acciaio per l'albero motore di un compressore del peso di 35 kg.
Lavoro indipendente
Che tipo di trasmissione del calore?
Gli studenti completano la tabella.
- L'aria nella stanza viene riscaldata attraverso le pareti.
- Attraverso finestra aperta, che include aria calda.
- Attraverso il vetro, che trasmette i raggi del sole.
- La terra è riscaldata dai raggi del sole.
- Il liquido viene riscaldato sul fornello.
- Il cucchiaio d'acciaio viene riscaldato dal tè.
- L'aria è riscaldata da una candela.
- Il gas si muove intorno alle parti che producono calore della macchina.
- Riscaldare la canna di una mitragliatrice.
- Latte bollente.
5. Compiti a casa: Peryshkin A.V. “Fisica 8” §§7, 8; raccolta di compiti 7-8 Lukashik V.I. N. 778-780, 792,793 2 min.
Il concetto della quantità di calore è stato formato fasi iniziali sviluppo della fisica moderna, quando non c'erano idee chiare in merito struttura interna materia, su cos'è l'energia, su quali forme di energia esistono in natura e sull'energia come forma di movimento e trasformazione della materia.
La quantità di calore è quantità fisica equivalente all'energia trasferita al corpo materiale nel processo di scambio termico.
L'unità obsoleta della quantità di calore è la caloria, pari a 4,2 J, oggi questa unità è praticamente inutilizzata, e il suo posto è stato preso dal joule.
Inizialmente, si presumeva che il portatore di energia termica fosse un mezzo completamente privo di peso che avesse le proprietà di un liquido. Numerosi problemi fisici di trasferimento del calore sono stati e sono tuttora risolti sulla base di questa premessa. L'esistenza di un ipotetico calorico è stata presa come base per molte costruzioni essenzialmente corrette. Si credeva che il calorico fosse rilasciato e assorbito nei fenomeni di riscaldamento e raffreddamento, fusione e cristallizzazione. Le equazioni corrette per i processi di trasferimento del calore sono state ottenute da concetti fisici errati. Esiste una legge nota secondo la quale la quantità di calore è direttamente proporzionale alla massa del corpo coinvolta nello scambio termico e al gradiente di temperatura:
Dove Q è la quantità di calore, m è la massa del corpo e il coefficiente Con- una grandezza detta capacità termica specifica. Il calore specifico è una caratteristica della sostanza coinvolta nel processo.
Lavoro in termodinamica
Come risultato di processi termici, puramente lavoro meccanico. Ad esempio, quando riscaldato, un gas aumenta il suo volume. Prendiamo una situazione come nella figura seguente:

In questo caso il lavoro meccanico sarà pari alla forza di pressione del gas sul pistone moltiplicata per il percorso percorso dal pistone in pressione. Naturalmente, questo è il caso più semplice. Ma anche in esso si può notare una difficoltà: la forza di pressione dipenderà dal volume del gas, il che significa che non si tratta di costanti, ma di variabili. Poiché tutte e tre le variabili: pressione, temperatura e volume sono correlate tra loro, il calcolo del lavoro diventa molto più complicato. Esistono alcuni processi ideali, infinitamente lenti: isobari, isotermici, adiabatici e isocori, per i quali tali calcoli possono essere eseguiti in modo relativamente semplice. Viene tracciato un grafico della pressione rispetto al volume e il lavoro viene calcolato come un integrale della forma.
