Betaferon: istruzioni per l'uso e recensioni
Nome latino: Betaferon
Codice ATX: L03AB08
Sostanza attiva: Interferone beta-1b (Interferone beta-1b)
Produttore: Boehringer Ingelheim Pharma (Germania)
Descrizione e aggiornamento foto: 06.08.2019
Betaferon è un farmaco immunomodulatore utilizzato nel trattamento della sclerosi multipla.
Forma e composizione del rilascio
Forma di dosaggio - liofilizzato per la preparazione di una soluzione per iniezione sottocutanea: massa bianca liofilizzata (in flaconi di vetro completi di solvente (in una siringa), in pallet di plastica, 5 o 15 pallet in una scatola di cartone).
In 1 flaconcino:
- Sostanza attiva: interferone ricombinante beta-1b - 9,6 milioni di UI (0,3 mg);
- Eccipienti: albumina umana, mannitolo.
Solvente: soluzione di cloruro di sodio 0,54% (sterile).
Farmacodinamica e farmacocinetica
L'interferone beta-lb, che fa parte del farmaco, ha attività immunomodulante e antivirale.
Il meccanismo d'azione di questa sostanza nella sclerosi multipla non è stato definitivamente stabilito, tuttavia, è noto che l'uso di Betaferon nella sclerosi multipla recidivante e secondaria progressiva può ridurre la frequenza (del 30%) e la gravità delle esacerbazioni cliniche della malattia , la necessità di un trattamento con glucocorticosteroidi, oltre a ridurre il numero di ricoveri e allungare la durata della remissione.
Durante il trattamento con Betaferon in pazienti con sclerosi multipla secondaria progressiva, si è verificato un ritardo nell'ulteriore progressione della malattia e nell'insorgenza della disabilità (anche grave, in cui i pazienti devono utilizzare costantemente una sedia a rotelle) fino a 12 mesi. Un effetto simile si verifica nei pazienti con o senza esacerbazioni della malattia, nonché con qualsiasi indice di disabilità (lo studio è stato condotto con la partecipazione di pazienti con un punteggio di 3-6,5 punti).
I risultati della risonanza magnetica cerebrale di pazienti con sclerosi multipla secondaria progressiva e recidivante confermano il fatto che il trattamento con il farmaco ha un effetto positivo sulla gravità processo patologico e riduce significativamente il rischio di nuove lesioni attive.
Non sono stati condotti studi di tossicità acuta. Studi di tossicità a dosi ripetute nelle scimmie rhesus indicano la possibilità di sviluppare ipertermia transitoria, che è accompagnata da una marcata diminuzione transitoria del numero di neutrofili e piastrine segmentati e da un aumento transitorio della concentrazione dei linfociti.
Studi di tossicità riproduttiva condotti su scimmie rhesus hanno dimostrato che Betaferon non solo è tossico per la madre, ma aumenta anche l'incidenza di aborti spontanei. Allo stesso tempo, non sono state osservate malformazioni nella prole vivente.
Non sono stati condotti studi sull'effetto del farmaco sulla fertilità, non è stato registrato alcun effetto sul ciclo estrale delle scimmie.
Un singolo studio di genotossicità (test di Ames) non è riuscito a rilevare alcun effetto mutageno.
Non sono stati inoltre condotti studi di cancerogenicità e i risultati del test di trasformazione cellulare in vitro non hanno mostrato la presenza di alcun potenziale cancerogeno.
Con la somministrazione sottocutanea delle dosi raccomandate di Betaferon (0,25 mg), le concentrazioni sieriche di interferone beta-lb sono basse o non vengono rilevate affatto. Ecco perché non ci sono dati sulla farmacocinetica del farmaco nei pazienti con sclerosi multipla che ricevono le dosi raccomandate del farmaco.
Con una dose sottocutanea di 0,5 mg, la concentrazione plasmatica massima si osserva 1-8 ore dopo l'iniezione ed è di circa 40 UI / ml. La biodisponibilità assoluta del farmaco quando somministrato per via sottocutanea è di circa il 50%.
A somministrazione endovenosa la clearance e l'emivita di Betaferon dal siero sono rispettivamente di 30 ml/min/kg e 5 ore.
Le iniezioni di Betaferon a giorni alterni non causano un aumento della concentrazione di interferone beta-lb nel plasma sanguigno e la farmacocinetica del farmaco durante l'intero corso della terapia non cambia.
La somministrazione sottocutanea del farmaco a giorni alterni alla dose di 0,25 mg porta ad un aumento significativo del contenuto dei marcatori di risposta biologica (interleuchina-10, neopterina, citochina immunosoppressiva, beta2-microglobulina) rispetto ai valori basali 6-12 ore dopo la prima dose del farmaco. Questo indicatore ha raggiunto il suo picco dopo 40-124 ore ed è rimasto elevato durante l'intero periodo di studio (7 giorni o 168 ore).
Indicazioni per l'uso
- Sindrome clinicamente isolata (l'unico episodio clinico di demielinizzazione, che consente, fatta salva l'esclusione di diagnosi alternative, di suggerire la sclerosi multipla);
- Sclerosi multipla secondaria progressiva con un decorso attivo della malattia, comprese esacerbazioni o un pronunciato deterioramento delle funzioni neurologiche negli ultimi anni (l'uso di Betaferon può ridurre la frequenza e la gravità di tali esacerbazioni, nonché rallentare il tasso di progressione della malattia);
- Sclerosi multipla recidivante-remittente. Il farmaco è efficace nel ridurre la frequenza e la gravità delle riacutizzazioni della malattia nei pazienti ambulatoriali (in grado di muoversi senza assistenza) con una storia di almeno due riacutizzazioni della malattia negli ultimi due anni, seguite da guarigione (completa o incompleta) di sintomi neurologici.
Controindicazioni
L'uso del farmaco è controindicato in gravidanza, allattamento, ipersensibilità ai componenti del farmaco.
La cautela richiede la nomina del farmaco a pazienti con malattie cardiache, così come trombocitopenia, anemia, compromissione della funzionalità epatica, depressione e pensieri suicidi nella storia.
L'esperienza con l'uso di Betaferon nei bambini è limitata.
Istruzioni per l'uso Betaferon: modalità e dosaggio
Il trattamento deve essere iniziato sotto la supervisione di un medico esperto.
Effetti collaterali
Quando si utilizza Betaferon, vari effetti collaterali. Da parte del corpo nel suo insieme, di solito si manifestano come astenia, malessere generale, reazione al sito di iniezione, mal di testa, dolore toracico, febbre, brividi, dolore addominale, dolore localizzazione diversa, necrosi nel sito di iniezione, un complesso di sintomi simil-influenzali, con lo sviluppo del quale il medico può prescrivere farmaci antinfiammatori non steroidei.
Il farmaco può causare alcune reazioni dermatologiche, solitamente manifestate come eruzioni cutanee e lesioni cutanee.
Inoltre, durante il trattamento con Betaferon, possono verificarsi con frequenza variabile disturbi del sistema cardiovascolare, muscoloscheletrico, nervoso, digestivo, urinario, respiratorio e riproduttivo.
Overdose
Con l'introduzione di Betaferon alla dose di 5,5 mg 3 volte a settimana, gravi reazioni avverse in pazienti adulti con malattie oncologiche non sono stati osservati.
istruzioni speciali
Betaferon contiene albumina umana, quindi esiste un rischio molto ridotto di trasmissione di malattie virali.
Pazienti durante trattamenti diversi da quelli standard test di laboratorio si raccomanda di eseguire regolarmente un esame del sangue dettagliato. I pazienti con anemia, leucopenia e trombocitopenia possono anche richiedere un monitoraggio più attento di un emocromo completo, compresa la determinazione del numero di leucociti, eritrociti, piastrine e formula leucocitaria.
In 1 flaconcino interferone beta-1b - 0,30 mg (o 9,6 milioni di UI). Albumina umana e mannitolo - come eccipienti.
Modulo per il rilascio
Liofilizzato per la preparazione di una soluzione o sospensione di 9,6 milioni di UI in un flaconcino.
effetto farmacologico
Immunomodulante.
Farmacodinamica e farmacocinetica
Farmacodinamica
Sostanza attiva interferone beta-1b ha effetti antivirali e immunomodulatori. Il suo meccanismo d'azione non è stato definitivamente stabilito, ma è noto che è associato a interazioni con determinati recettori. Il legame a questi recettori induce l'espressione di sostanze che sono state rilevate nel sangue dei pazienti trattati con questo farmaco. interferone beta aumenta l'effetto soppressivo dei globuli mononucleati.
In pazienti con forma progressiva secondaria RS l'uso del farmaco ritarda la progressione della malattia e della disabilità fino a un anno. risultati risonanza magnetica del cervello dei pazienti confermano le dinamiche positive: una diminuzione della formazione di nuovi focolai. Lo studio di tossicità e cancerogenicità del farmaco non è stato condotto. Test di trasformazione cellulare effettuato in vitro non ha mostrato attività cancerogena.
Farmacocinetica
Quando somministrato per via sottocutanea alla dose di 1 ml (0,25 mg) di concentrazione interferone beta nel sangue sono bassi o non rilevati, quindi non ci sono informazioni sulla farmacocinetica. Con l'introduzione di 0,5 mg, la concentrazione massima viene determinata dopo 1-8 ore. Biodisponibilità 50%. Se il farmaco è stato somministrato per via endovenosa, la sua emivita è di 5 ore.
La somministrazione sottocutanea a giorni alterni non provoca un aumento della concentrazione ematica. A applicazione sottocutanea a giorni alterni alla dose di 0,25 mg, gli indicatori dei marcatori di risposta biologica aumentano significativamente 6-12 ore dopo la prima dose, raggiungono un picco dopo 40-125 ore e rimangono elevati per 168 ore.
Indicazioni per l'uso
- sindrome isolata con un pronunciato processo infiammatorio, in cui vi sono indicazioni per l'uso di somministrazione endovenosa corticosteroidi , al fine di rallentare il passaggio all'affidabile RS . Questi sono di solito pazienti con manifestazioni cliniche più di un focolare SNC ;
- SM recidivante-remittente (al fine di ridurre la frequenza delle riacutizzazioni in presenza di 2 o più riacutizzazioni in 2 anni con recupero incompleto dello stato neurologico);
- SM progressiva secondaria , che ha un decorso attivo con esacerbazioni per 2 anni e un pronunciato deterioramento dello stato neurologico (al fine di ridurre la frequenza delle esacerbazioni e rallentare la progressione).
Controindicazioni
- ipersensibilità;
- allattamento.
Usato con cautela quando insufficienza cardiaca III-IV stadi, anemia , leucopenia e compromissione della funzionalità epatica.
Effetti collaterali
Reazioni comuni:
- reazioni al sito di iniezione (dolore, iperemia , infiammazione, );
- sintomi simil-influenzali (brividi, mialgia ).
Reazioni rare:
- malessere, dolore toracico;
- anemia , leucopenia ;
- perdita o aumento di peso;
- O ;
- ipertonicità muscoli;
- convulsioni , agitazione, tentativi di suicidio, labilità emotiva;
- , aumento ;
- E broncospasmo ;
- mialgia E artralgia ;
- nausea;
- , reazioni anafilattiche;
- , prurito, eruzione cutanea;
- violazioni ciclo mestruale.
Reazioni molto rare:
- vasodilatazione ;
- menorragia .
Betaferon, istruzioni per l'uso (metodo e dosaggio)
Il farmaco viene somministrato per via sottocutanea. Per la dissoluzione della polvere interferone beta 1,2 ml di solvente vengono iniettati nel flaconcino. La polvere si scioglie bene senza agitare. Se sono presenti particelle non disciolte, la soluzione non può essere utilizzata.
Betaferon a sclerosi multipla somministrato a giorni alterni, 1 ml di soluzione (0,25 mg interferone beta ). In caso di salto di un'iniezione, viene eseguita immediatamente e quella successiva viene prodotta, come dovrebbe essere, dopo 48 ore. La durata del corso è determinata dal medico, negli studi clinici ha raggiunto dai 3 ai 5 anni.
Overdose
Anche con l'introduzione del farmaco per via endovenosa a 5,5 mg tre volte, non si sono verificate reazioni avverse significative.
Interazione
Non sono stati condotti studi di interazione con altri farmaci. Glucocorticosteroidi usati contemporaneamente per le riacutizzazioni sono ben tollerati. L'uso di Betaferon con altri immunomodulatori non è stato studiato. Prestare attenzione quando si prescrive insieme a farmaci la cui clearance è dipendente dal sistema citocromo P450 (antidepressivi, farmaci antiepilettici), nonché farmaci che influenzano l'ematopoiesi. Non mescolare con farmaci nella stessa siringa.
Condizioni di vendita
Su prescrizione medica.
Condizioni di archiviazione
Temperatura fino a 25°С.
Da consumarsi preferibilmente entro
Analoghi di Betaferon
Coincidenza nel codice ATX del 4° livello:infibeta , Ronbetal , Extavia .
Catad_pgroup Farmaci per la sclerosi multipla
Betaferon - istruzioni per l'uso
NUMERO DI REGISTRAZIONE:
DENOMINAZIONE COMMERCIALE DEL FARMACO:
Betaferon
DENOMINAZIONE INTERNAZIONALE NON PROPRIETARIA:
Interferone beta-1b
FORMA FARMACEUTICA:
Lyophilisate per preparazione di soluzione per amministrazione sottocutanea
COMPOSTO
Ogni flacone con il principio attivo contiene: interferone beta-1b (IFN-beta-1b) - 0,30 mg (corrisponde a 9,6 milioni di UI), albumina umana - 15,00 mg, mannitolo - 15,00 mg.
1 ml della soluzione preparata contiene 0,25 mg (8,0 milioni di UI) di interferone beta-1b ricombinante.
1 ml di solvente acquoso per soluzione iniettabile contiene 5,4 mg di cloruro di sodio.
DESCRIZIONE
Liofilizzato: Massa liofilizzata di colore bianco.
Solvente: Soluzione limpida, quasi incolore.
Soluzione ricostituita: Soluzione da leggermente opalescente a opalescente, incolore o giallo chiaro.
GRUPPO FARMACOTERAPEUTICA
Citochina. Mezzi per il trattamento della sclerosi multipla.
CODICE ATH: L03AB08
PROPRIETÀ FARMACOLOGICHE
Farmacodinamica
Gli interferoni sono proteine appartenenti alla famiglia delle citochine e aventi un peso molecolare compreso tra 15.000 e 21.000 dalton. Esistono tre classi di interferoni: interferone alfa, interferone beta e interferone gamma, che hanno attività biologiche diverse ma sovrapposte. L'attività dell'interferone beta-1b è specie-specifica, quindi le informazioni farmacologiche più significative sull'interferone beta-1b possono essere ottenute da studi con colture cellule umane o in studi in vivo sugli esseri umani.
Il principio attivo del farmaco Betaferon (interferone beta-1b) ha attività antivirale e immunomodulante. I meccanismi d'azione dell'interferone beta-1b nella sclerosi multipla (SM) non sono stati completamente stabiliti. Tuttavia, è noto che l'effetto biologico dell'interferone beta-1b è mediato dalla sua interazione con specifici recettori presenti sulla superficie delle cellule umane. Il legame dell'interferone beta-1b a questi recettori induce l'espressione di un certo numero di sostanze che sono considerate mediatori degli effetti biologici dell'interferone beta-1b. Il contenuto di alcune di queste sostanze è stato determinato nelle frazioni sieriche ed ematiche di pazienti trattati con interferone beta-1b. L'interferone beta-1b riduce la capacità di legame e migliora anche l'internalizzazione e la degradazione dei recettori per l'interferone gamma. Inoltre, l'interferone beta-1b aumenta l'attività di soppressione delle cellule mononucleate del sangue periferico. Studi separati sull'effetto di Betaferon sul sistema cardiovascolare, respiratorio e sistema endocrino non sono stati eseguiti.
Ricerche cliniche:
Sclerosi multipla recidivante-remittente
In uno studio clinico su pazienti con sclerosi multipla recidivante-remittente che erano in grado di camminare senza assistenza ( valore base EDSS da 0 a 5,5), il trattamento con Betaferon ha dimostrato di ridurre la frequenza (del 30%) e la gravità delle esacerbazioni cliniche della malattia, il numero di ricoveri dovuti alla malattia e anche di prolungare la durata della remissione. Non sono disponibili informazioni sull'effetto della terapia con Betaferon sulla durata della recidiva o sull'insorgenza dei sintomi tra le riacutizzazioni, nonché sulla progressione della malattia nella sclerosi multipla recidivante-remittente.
Sclerosi multipla secondaria progressiva:
Sono stati condotti due studi clinici controllati su 1657 pazienti con SM progressiva secondaria (EDSS basale da 3 a 6,5, cioè pazienti in grado di camminare). Pazienti con grado lieve malattie, così come i pazienti impossibilitati a muoversi, non sono stati inclusi negli studi. I risultati di entrambi gli studi hanno mostrato risultati contrastanti per l'endpoint primario, il tempo alla progressione della malattia confermata, di ritardare la progressione della disabilità.
In uno dei due studi è stato dimostrato un ritardo statisticamente significativo nella progressione della disabilità durante il trattamento con Betaferon (rapporto di rischio = 0,69, 95% intervallo di confidenza(0,55; 0,86), p=0,0010 corrispondono a una riduzione del rischio del 31% a seguito della terapia con Betaferon) e grave disabilità (cioè quando i pazienti sono costretti a utilizzare costantemente una sedia a rotelle) (hazard ratio = 0,61, 95% intervallo di confidenza ( 0,44; 0,85), p=0,0036 corrispondono a una riduzione del rischio del 39% come risultato della terapia con Betaferon). Questo effetto è stato osservato per 33 mesi in pazienti con qualsiasi indice di disabilità, indipendentemente dalla frequenza delle recidive. In un secondo studio condotto su pazienti con SM secondaria progressiva, non vi è stato alcun ritardo nell'insorgenza della disabilità a seguito del trattamento con Betaferon. Ci sono prove che i pazienti arruolati questo studio, erano in una fase meno attiva della malattia rispetto ai pazienti che hanno partecipato al primo studio.
I dati di una meta-analisi retrospettiva di entrambi gli studi hanno mostrato un effetto complessivo statisticamente significativo della terapia (p = 0,0076; 8 milioni UI di Betaferon rispetto ai pazienti trattati con placebo).
Un'analisi retrospettiva per sottogruppi ha mostrato che il trattamento con Betaferon aveva maggiori probabilità di avere un impatto sul tempo di insorgenza della disabilità nei pazienti con malattia attiva prima della terapia (rapporto di rischio 0,72, intervallo di confidenza al 95% (0,59; 0,88), p= 0,0011 corrisponde a una riduzione del rischio del 28% come risultato della terapia con Betaferon in pazienti con recidive o grave progressione di EDSS, 8 milioni UI di Betaferon rispetto ai pazienti trattati con placebo). I dati retrospettivi suggeriscono che le recidive e la marcata progressione dell'EDSS (EDSS >1 o EDSS >0,5 per EDSS >6 nei due anni precedenti) possono aiutare a identificare i pazienti con malattia attiva.
In entrambi gli studi su pazienti con sclerosi multipla secondaria progressiva, il trattamento con Betaferon ha ridotto del 30% la frequenza delle riacutizzazioni cliniche. Non c'erano dati sull'effetto della terapia sulla durata delle recidive.
Sindrome clinicamente isolata suggestiva di sclerosi multipla
È stato condotto uno studio clinico controllato su pazienti con sindrome clinicamente isolata e risultati di risonanza magnetica cerebrale (MRI) suggestivi di sclerosi multipla (almeno due lesioni non clinicamente evidenti nelle immagini MRI pesate in T2). Lo studio ha incluso pazienti con un esordio monofocale o multifocale della malattia (cioè pazienti con manifestazioni cliniche di una o almeno due lesioni del sistema nervoso). I pazienti con sintomi di qualsiasi malattia simili a quelli della sclerosi multipla sono stati esclusi dallo studio.
Questo studio comprendeva 2 fasi: una fase controllata con placebo (placebo rispetto a Betaferon) seguita da una fase di follow-up pre-pianificata. La fase controllata con placebo è durata 2 anni o fino allo sviluppo della sclerosi multipla clinicamente significativa (MSMS), a seconda di quale evento si sia verificato per primo. Dopo il completamento della fase controllata con placebo dello studio, i pazienti sono entrati in una fase di follow-up pre-programmata per confrontare gli effetti dell'inizio precoce rispetto a quello tardivo della terapia con Betaferon. Sono stati effettuati confronti tra i pazienti inizialmente randomizzati a Betaferon (gruppo di inizio precoce di betaferon) e placebo (gruppo di inizio tardivo).
Tabella 1.
RRisultati primari di efficacia basati sui dati dello studio BENEFICIO e risultati del follow-up secondo lo studioBENEFICIO Seguire- su.

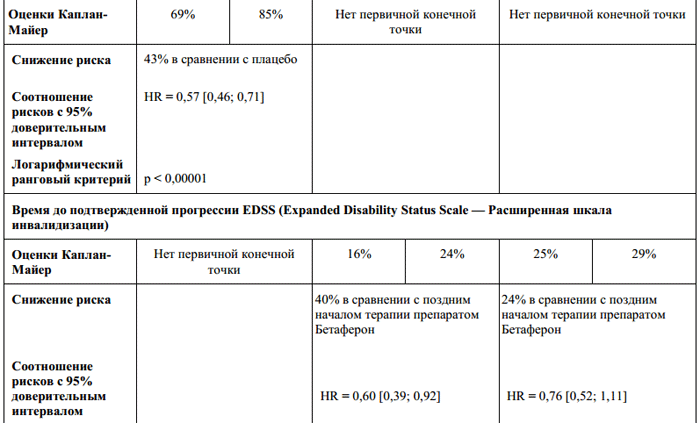
Nella fase dello studio controllata con placebo, Betaferon ha rallentato la progressione della malattia dalla prima manifestazione clinica alla sclerosi multipla clinicamente significativa. La terapia con Betaferon ha causato un ritardo stabile nella progressione della sclerosi multipla secondo i criteri di McDonald (Tabella 1).
Il trattamento con Betaferon ha avuto un effetto sulla progressione della malattia a CRMS in tutti i sottogruppi analizzati. I pazienti con una forma monolesionale e almeno nove lesioni su immagini pesate in T2 o Gd-enhancement sulla risonanza magnetica cerebrale al basale avevano un aumentato rischio di progressione della malattia a CRMS entro 2 anni. Nei pazienti con una forma multifocale, i tempi dello sviluppo della malattia prima della CRMS non dipendevano dai parametri MRI iniziali, che si basano su
le osservazioni cliniche hanno indicato un alto rischio di CRMS dovuto aprogressione della malattia. SU questo momento non esiste una definizione chiara
definizione del concetto di “rischio elevato”. Un approccio più conservativo consisterebbe nell'identificare almeno nove lesioni iperintense su immagini pesate in T2 alla scansione iniziale e almeno una nuova lesione su immagini pesate in T2 o una nuova lesione potenziata con Gd almeno un mese dopo la scansione iniziale. . In ogni caso, il trattamento dovrebbe essere somministrato solo a pazienti ad alto rischio.
L'elevata percentuale di pazienti che hanno completato lo studio (93% del gruppo Betaferon) ha indicato che il trattamento con Betaferon è stato ben tollerato. Per aumentare la tollerabilità del farmaco all'inizio della terapia, sono state eseguite la titolazione della dose e l'introduzione di farmaci antinfiammatori non steroidei. Inoltre, durante l'intero studio, alla maggior parte dei pazienti è stato somministrato il farmaco utilizzando un autoiniettore.
Nella successiva fase di osservazione aperta, l'effetto della terapia dopo 3 e 5 anni di trattamento è stato evidente (Tabella 1), anche se la maggior parte dei pazienti nel gruppo placebo ha ricevuto il trattamento con Betaferon almeno dal secondo anno di malattia. Nel gruppo con trattamento precoce con Betaferon (Tabella 1, effetto pronunciato dopo 3 anni, nessun effetto significativo dopo 5 anni), la progressione della malattia sulla scala EDSS (aumento confermato di EDSS di almeno un punto rispetto al basale) è stata inferiore. La maggior parte dei pazienti in entrambi i gruppi non ha avuto progressione della disabilità entro 5 anni. Per "l'inizio precoce della terapia", non è stato dimostrato alcun effetto prolungato su questo basale. Non sono stati riscontrati benefici in termini di qualità della vita, come determinato in accordo con il FAMS (Valutazione Funzionale della SM - valutazione funzionale della sclerosi multipla: indice di trattamento, esito), a causa dell'inizio precoce della terapia con Betaferon.
Sclerosi multipla recidivante-remittente, sclerosi multipla secondaria progressiva e una sindrome clinicamente isolata suggestiva di sclerosi multipla.
I risultati della risonanza magnetica nei pazienti con sclerosi multipla hanno dimostrato l'efficacia del farmaco Betaferon e il rallentamento del decorso della malattia in tutti gli studi. Secondo i risultati della valutazione della risonanza magnetica, la relazione tra il decorso della sclerosi multipla e l'esito clinico non è stata ancora chiarita.
Caratterizzazione tossicologica
Non sono stati condotti studi di tossicità acuta. Poiché i roditori sono insensibili agli effetti dell'interferone beta umano, la valutazione del rischio si è basata su studi di tossicità a dosi ripetute nelle scimmie rhesus. È stata osservata ipertermia transitoria, insieme a un pronunciato aumento transitorio della concentrazione dei linfociti e una diminuzione transitoria delle piastrine e dei neutrofili segmentati.
Non sono stati condotti studi di tossicità a lungo termine. Studi sulla tossicità riproduttiva nelle scimmie rhesus hanno mostrato tossicità materna e un aumento dei tassi di aborto spontaneo. Non sono state osservate malformazioni nella prole vivente. Non sono stati condotti studi sull'effetto sulla fertilità. Non è stato osservato alcun effetto sul ciclo estrale della scimmia.
In uno studio separato genotossicità (test di Ames), non sono stati osservati effetti mutageni. Non sono stati condotti studi di cancerogenicità. Un test di trasformazione cellulare in vitro non ha rivelato alcun potenziale cancerogeno.
Farmacocinetica
La concentrazione plasmatica di interferone beta-1b nei pazienti e nei volontari è stata determinata utilizzando uno specifico test biologico.
Dopo l'iniezione sottocutanea di 0,5 mg (16,0 milioni di UI) di interferone beta-1b, la concentrazione plasmatica massima viene raggiunta 1-8 ore dopo l'iniezione ed è di circa 40 UI/ml. Secondo vari studi, con la somministrazione endovenosa di interferone beta-1b, la clearance e la sua emivita dal plasma sono in media rispettivamente di 30 ml/min/kg e 5 ore.
L'introduzione del farmaco Betaferon a giorni alterni non porta ad un aumento della concentrazione di interferone beta-1b nel plasma sanguigno e la sua farmacocinetica durante il corso della terapia non cambia.
Con la somministrazione sottocutanea di interferone beta-1b, la biodisponibilità assoluta è di circa il 50%.
INDICAZIONI PER L'USO
Sindrome clinicamente isolata (CIS) (l'unico episodio clinico di demielinizzazione indicativo di sclerosi multipla, soggetto all'esclusione di diagnosi alternative) con gravità sufficiente processo infiammatorio per la somministrazione di corticosteroidi per via endovenosa
rallentando la transizione verso la sclerosi multipla clinicamente significativa (CRMS) nei pazienti ad alto rischio di sviluppare CRMS.
Non esiste una definizione generalmente accettata di rischio elevato. Secondo lo studio, i pazienti con CIS monofocale (manifestazioni cliniche di 1 lesione nel sistema nervoso centrale) e ≥ 9 focolai su immagini pesate in T2 alla risonanza magnetica e/o cumulative agente di contrasto fuochi. I pazienti con CIS multifocale (manifestazioni cliniche di >1 lesione nel sistema nervoso centrale) sono ad alto rischio di sviluppare CRMS, indipendentemente dal numero di focolai alla RM.
Sclerosi multipla recidivante-remittente (RRMS) - per ridurre la frequenza e la gravità delle riacutizzazioni nei pazienti ambulatoriali (cioè pazienti in grado di camminare senza assistenza) con una storia di almeno 2 riacutizzazioni negli ultimi due anni, seguite da un ripristino completo o incompleto della deficit neurologico.
Sclerosi multipla secondaria progressiva con un decorso attivo della malattia, caratterizzato da esacerbazioni o un pronunciato deterioramento delle funzioni neurologiche negli ultimi due anni - per ridurre la frequenza e la gravità delle esacerbazioni cliniche della malattia, nonché per rallentare il tasso di progressione della malattia.
CONTROINDICAZIONI
- Gravidanza.
- Allattamento al seno.
- Reazioni di ipersensibilità all'interferone beta naturale o ricombinante nella storia e ai componenti che compongono il farmaco.
- Depressione grave e/o pensieri suicidi.
- Malattie del fegato nella fase di scompenso.
- Infanzia fino a 18 anni (le informazioni sull'efficacia e la sicurezza dell'uso dell'interferone beta-1b nei bambini sono limitate).
ACCURATAMENTE
Betaferon deve essere usato con cautela nei pazienti con le seguenti condizioni:
- malattie cardiache, in particolare, insufficienza cardiaca classe funzionale III-IV secondo la classificazione della New York Heart Association (NYHA), cardiomiopatia;
- crisi epilettiche nella storia;
- gammopatia monoclonale;
- anemia, trombocitopenia, leucopenia;
- grave insufficienza renale.
UTILIZZO IN GRAVIDANZA E DURANTE L'ALLATTAMENTO
Gravidanza
Esistono informazioni limitate sulla possibilità che Betaferon causi danno fetale se trattato in donne in gravidanza o che influisca sulla funzione riproduttiva umana. In studi clinici controllati su pazienti con sclerosi multipla, si sono verificati casi di aborto spontaneo. L'uso del farmaco Betaferon durante la gravidanza è controindicato.
Le donne in età riproduttiva durante la terapia con Betaferon devono utilizzare metodi contraccettivi affidabili. In caso di gravidanza durante il trattamento o durante la pianificazione di una gravidanza, la paziente deve essere informata del potenziale rischio per il feto. In questo caso, si consiglia di annullare l'uso di Betaferon.
Nelle pazienti con un alto tasso di recidiva nell'anamnesi, prima di iniziare la terapia, è necessario valutare il rischio di sviluppare una grave ricaduta dopo l'interruzione del trattamento con il farmaco durante la gravidanza rispetto al possibile rischio di aborto spontaneo.
periodo di allattamento al seno
Non è noto se l'interferone beta-1b sia secreto da latte materno. Considerando la possibilità teorica di sviluppare reazioni avverse al farmaco Betaferon nei bambini che stanno assumendo allattamento al seno, è necessario interrompere l'allattamento al seno o sospendere il farmaco.
MODALITÀ DI APPLICAZIONE E DOSI
La terapia con Betaferon deve essere iniziata sotto la supervisione di un medico esperto nel trattamento della sclerosi multipla.
All'inizio del trattamento, di solito si raccomanda di titolare la dose. Il trattamento deve iniziare con l'introduzione di 0,0625 mg (0,25 ml) per via sottocutanea a giorni alterni, aumentando gradualmente la dose a 0,250 mg (1,0 ml), anch'essa somministrata a giorni alterni. Il periodo di titolazione della dose può essere modificato in caso di qualsiasi reazione avversa significativa. Per ottenere una sufficiente efficacia della terapia, deve essere somministrata una dose di 0,250 mg (1,0 ml) a giorni alterni.
Tabella per la titolazione della dose:
Negli studi clinici, la durata del trattamento nei pazienti con sclerosi multipla recidivante-remittente e secondaria progressiva ha raggiunto rispettivamente 5 anni e 3 anni.
Nella sclerosi multipla recidivante-remittente, l'efficacia del trattamento con Betaferon è stata dimostrata durante i primi due anni di terapia. Dati disponibili per ulteriori 3 periodo estivo terapia sono coerenti con i dati sull'efficacia del trattamento con Betaferon durante l'intero periodo di trattamento.
Nei pazienti con una sindrome clinicamente isolata suggestiva di sclerosi multipla, la progressione della malattia a CRMS è stata ritardata di un periodo di 5 anni.
La terapia con Betaferon non è raccomandata nei pazienti con sclerosi multipla recidivante-remittente che hanno avuto meno di due recidive negli ultimi 2 anni e nei pazienti con sclerosi multipla secondaria progressiva che non hanno manifestato fase attiva malattia negli ultimi 2 anni.
Il trattamento con Betaferon deve essere interrotto se il paziente non risponde alla terapia, ad esempio, vi è una progressione costante della malattia entro 6 mesi sulla scala EDSS (scala della disabilità estesa) o, nonostante il trattamento con Betaferon, almeno tre cicli di È necessaria la terapia con ACTH (ormone adrenocorticotropo) o corticosteroidi per 1 anno.
Preparazione della soluzione per iniezione
UN. Confezione del farmaco contenente flaconcini e siringhe preriempite:
Per sciogliere la polvere liofilizzata di interferone beta-1b per iniezione, utilizzare la siringa già pronta fornita con solvente e un ago.
B. Confezione del farmaco contenente flaconcini, siringhe preriempite, adattatore per flaconcino con ago e salviettine imbevute di alcool:
Per sciogliere la polvere liofilizzata di interferone beta-1b per iniezione, utilizzare la siringa già pronta fornita con diluente e un adattatore per flaconcino con ago.
1,2 ml di un solvente (soluzione di cloruro di sodio allo 0,54%) vengono iniettati in un flaconcino con Betaferon. La polvere dovrebbe dissolversi completamente senza agitare. Prima dell'uso, è necessario ispezionare la soluzione finita, che dovrebbe essere da leggermente opalescente a opalescente, incolore o giallo chiaro. In presenza di particelle o di un cambiamento nel colore della soluzione, non deve essere utilizzato.
La soluzione non utilizzata deve essere eliminata.
1 ml della soluzione preparata contiene 0,25 mg (8 milioni di UI) di interferone beta-1b.
La quantità di farmaco richiesta in base alla dose titolata viene aspirata nella siringa dopo la preparazione della soluzione.
Tecnica di autoiniezione per i pazienti
Per preparare la tua iniezione e iniezione di Betaferon, leggi attentamente le istruzioni e seguile passo dopo passo. Il medico o l'infermiere ti familiarizzeranno con la procedura e la tecnica di autoiniezione e ti aiuteranno a imparare. Non cerchi di iniettarsi finché non è sicuro di aver compreso correttamente i requisiti per preparare la soluzione, così come la tecnica di autoiniezione.
A. Confezione del farmaco contenente flaconcini e siringhe preriempite.
- Preparazione per l'iniezione.
- L'introduzione del volume richiesto di solvente (1,2 ml) nella fiala con Betaferon.
- Impostare il volume richiesto di soluzione iniettabile (1,0 ml) in una siringa.
Preparazione per un'iniezione
1. Prima di fare un'iniezione, prenda tutto il necessario per l'iniezione.
Per questo avrai bisogno di:
- siringa riempita con diluente Betaferon (soluzione di cloruro di sodio allo 0,54%)
- flaconcino di Betaferon
- ago 21G
- ago 30G
- salviette imbevute di alcol
- contenitore per siringhe e aghi usati
2. Lavarsi accuratamente le mani con il sapone.
3. Rimuovere il cappuccio protettivo dal flaconcino di Betaferon.
4. Pulisca il cappuccio del flaconcino di Betaferon con una salvietta imbevuta di alcool (pulisca in una direzione e usi una salvietta).
NOTA: Lasciare il tampone imbevuto di alcol sul tappo del flaconcino e non rimuoverlo finché non si è pronti a utilizzare il flaconcino.
L'introduzione del volume richiesto del solvente (1,2 ml) nella fiala con il farmaco Betaferon
NOTA: prendere il flaconcino di Betaferon e gettare il tampone imbevuto di alcool sopra.
1. Tenendo le mani su una superficie stabile, rimuovere la siringa di solvente dalla confezione. Tirare il cappuccio per rimuoverlo dalla base della siringa. Non tocchi la punta aperta della siringa. Non premere sul pistone.
2. Rimuovere l'ago 21G dalla confezione e inserirlo saldamente nella punta della siringa. Rimuovere il cappuccio protettivo dall'ago. Non toccare l'ago.
3. Con il flaconcino di Betaferon su una superficie stabile, inserire lentamente l'ago della siringa (contenente 1,2 ml di solvente) fino in fondo attraverso il tappo del flaconcino.
4. Spingere lentamente verso il basso il pistone. L'ago dovrebbe puntare verso il lato così
in modo che il liquido scorra lungo la parete del flaconcino (se si immette il solvente direttamente nel
polvere, quindi si forma molta schiuma).
5. Assicurarsi che l'ago non entri in contatto con la polvere o con ciò che ne risulta
soluzione.
6. Dopo aver iniettato l'intero contenuto della siringa nel flaconcino di Betaferon, tenga il flaconcino tra il pollice, l'indice e il medio in modo che l'ago e la siringa siano sul braccio.
7. Ruoti con cautela il flaconcino nella mano per dissolvere completamente la polvere di Betaferon. NON AGITARE!
8. Ispezionare attentamente la soluzione (dovrebbe essere trasparente).
NOTA: Se la miscela contiene particelle o ha cambiato colore, versatela e ricominciate l'intera procedura dall'inizio.
Un set del volume richiesto di soluzione iniettabile (1,0 ml) in una siringa
NOTA: Prima di aspirare la soluzione preparata, premere completamente lo stantuffo della siringa per rimuovere l'aria eventualmente rimasta all'interno della siringa.
1. Inclinare leggermente il flaconcino di soluzione di Betaferon e inserire la punta dell'ago
il punto più basso della fiala.
NOTA: Accertarsi di tenere sempre la punta dell'ago nella soluzione.
2. Tirare lo stantuffo e aspirare 1,0 ml di liquido nella siringa fino al segno.
3. Capovolga il flaconcino e tenga la siringa con l'ago rivolto verso l'alto.
4. Picchiettare delicatamente la siringa per far entrare le bolle d'aria parte superiore cilindro.
5. Spinga delicatamente verso il basso lo stantuffo in modo che dalla siringa fuoriesca SOLO ARIA.
6. Separare la siringa dall'ago. Lasci l'ago nel flaconcino.
7. Posizionare la siringa (senza l'ago) su una superficie piana. Assicurarsi che la punta della siringa non tocchi la superficie.
8. Prendi un ago da 30G, estrailo dalla confezione e posizionalo saldamente sulla punta della siringa.
9. Eliminare il flacone con la soluzione rimanente e l'ago.
Ora sei pronto per l'iniezione.
B. Confezione del farmaco contenente flaconcini, siringhe preriempite, un adattatore per flaconcino con ago e salviettine imbevute di alcol.
Fasi di preparazione della soluzione:
1 - Lavarsi accuratamente le mani con sapone prima di iniziare la procedura.
2 - Apri il flacone con Betaferon - meglio non con un'unghia, perché può rompersi, ma con il pollice - e mettilo sul tavolo.

3 - Pulire il tappo del flaconcino con una salvietta imbevuta di alcol. Spostare la salvietta in una sola direzione e poi lasciarla sul tappo del flaconcino.

4 - Apra il blister contenente l'adattatore del flaconcino, ma lasci l'adattatore all'interno.
Non rimuovere l'adattatore del flaconcino dal blisterconfezione.
Inoltre, faccia attenzione a non toccare l'adattatore del flaconcino. È importante che rimanga sterile.

5 - Tenere il flaconcino su una superficie piana mentre si collega l'adattatore.
6 - Rimuovere il tampone imbevuto di alcool dal tappo del flaconcino di Betaferon. Posizionare il blister contenente il dispositivo di trasferimento della soluzione con l'adattatore del flaconcino sul tappo del flaconcino. Premere sul blister con un grande dita indice o il palmo finché non scatta.

7 - Afferrare i bordi del blister e rimuoverlo dall'adattatore del flaconcino. Ora sei pronto per collegare la siringa di solvente preriempita al dispositivo di trasferimento della soluzione.

8 - Prendi la siringa. Torca il cappuccio arancione sulla punta della siringa e lo estragga dalla siringa. Butta via il tappo.

9 - Fissare la siringa al foro sul lato dell'adattatore inserendo la punta della siringa al suo interno e fissarla con cura premendo mentre si gira in senso orario (come mostrato dalla freccia) per formare il gruppo con la siringa.

10 - Tenere il gruppo con la siringa sul fondo del flaconcino. Spingere lentamente lo stantuffo della siringa fino in fondo per spostare tutto il diluente nel flaconcino. Rilasciare il pistone. In questo caso, il pistone può tornare nella sua posizione originale.

11 - Effettuare alcuni delicati movimenti rotatori con il flacone in modo che la polvere secca di Betaferon sia completamente sciolta. In questo caso il disegno con la siringa rimane ancora attaccato alla fiala.
Non agitare il flaconcino.

12 - Ispezionare attentamente la soluzione. Dovrebbe essere trasparente e non contenere particelle. Se
la soluzione ha cambiato colore o contiene particelle, versarla e ricominciare l'intera procedura dall'inizio, prendendo una nuova confezione di accessori. Se appare la schiuma - cosa può succedere se la fiala viene agitata o
ruotare troppo - lasciare riposare la bottiglia fino a quando la schiuma non si deposita.
Preparazione della siringa

13 - Se il pistone è tornato nella sua posizione originale, spingerlo nuovamente dentro e fissarlo. Per preparare l'iniezione, capovolga il gruppo in modo che il flaconcino sia in alto e il cappuccio del flaconcino sia rivolto verso il basso. Ciò consentirà alla soluzione di defluire nella siringa.
Tenere la siringa orizzontalmente.
Tirare indietro lentamente lo stantuffo per aspirare tutta la soluzione dal flaconcino nella siringa.
14 - Ruotare il gruppo siringa in modo che l'ago sia rivolto verso l'alto. Ciò farà salire le bolle d'aria sulla superficie della soluzione.

15 - Rimuovere le bolle d'aria picchiettando delicatamente sulla siringa e spostando lo stantuffo fino alla tacca da 1 ml o più.
importo prescritto dal medico.
Se nel flaconcino è stata forzata troppa soluzione insieme a bolle d'aria, tirare leggermente indietro lo stantuffo per aspirare nuovamente la soluzione dal flaconcino nella siringa. Fallo fino a quando tutta l'aria non viene rimossa e la siringa contiene 1 ml della soluzione preparata.
Nota importante : Quando si raccoglie nuovamente la soluzione, riportare il gruppo siringa in posizione orizzontale, in cui il flaconcino si trova in alto.

16 - Quindi afferrare l'adattatore blu del flaconcino insieme al flaconcino attaccato ad esso,
girare l'adattatore verso di sé, quindi separarlo dalla siringa.
Quando si separa l'adattatore del flaconcino dalla siringa, afferrare solo l'adattatore di plastica blu. Tenere la siringa in posizione orizzontale; il flaconcino dovrebbe essere sotto la siringa.

17 - A seguito del distacco del flaconcino e dell'adattatore dalla siringa, la soluzione fuoriesce dall'ago durante l'iniezione.
18 - Ora sei pronto per l'iniezione.
NOTA: Il farmaco deve essere somministrato per via sottocutanea immediatamente dopo la preparazione della soluzione. Se l'iniezione viene ritardata, la soluzione deve essere conservata in frigorifero e utilizzata entro 3 ore.La soluzione non deve essere congelata.
19 - Gettare il flaconcino e la restante soluzione inutilizzata in un contenitore per
sciupare.
Breve descrizione preparazione del farmaco per l'iniezione
1. Rimuovere il contenuto dalla confezione.
2. Collegare l'adattatore del flaconcino al flaconcino.
3. Collegare la siringa all'adattatore del flaconcino.
4. Spingere lo stantuffo per spostare il diluente nel flaconcino.
5. Capovolgere il gruppo siringa, quindi tirare indietro lo stantuffo.
6. Separi il flaconcino dalla siringa: ora sei pronto per l'iniezione.
NOTA: Il farmaco deve essere somministrato per via sottocutanea immediatamente dopo la preparazione della soluzione. Se l'iniezione viene ritardata, la soluzione deve essere conservata in frigorifero e utilizzata entro 3 ore.La soluzione non deve essere congelata.
Selezione e preparazione del sito di iniezione e somministrazione della soluzione farmacologica
Betaferon (1,0 ml) per via sottocutanea
- Scelta del sito di iniezione
Betaferon (interferone beta-1b) deve essere somministrato per via sottocutanea. I punti deboli lontani dalle articolazioni e dai nervi sono i più adatti per questo.
I siti di iniezione possono essere selezionati utilizzando il disegno. È meglio determinare prima il sito di iniezione, quindi preparare la siringa.
Se trovi difficile raggiungere qualsiasi luogo, chiedi aiuto a qualcuno che sa come fare le iniezioni.
1 - Selezionare il sito di iniezione (vedere la figura "Iniezioni alternate" alla fine delle istruzioni).
NOTA IMPORTANTE: Non iniettare in aree in cui sono presenti rigonfiamenti, gonfiori, noduli duri o indolenzimento. Inoltre, la soluzione non deve essere iniettata in quelle aree in cui vi sono cambiamenti nel colore della pelle, depressioni, croste o l'integrità della pelle è rotta. Se si verificano queste o altre condizioni insolite, contattare il proprio medico.
2 - Pulire la pelle nel sito di iniezione con un tampone imbevuto di alcol e lasciare asciugare la pelle all'aria. Butta via il tovagliolo.
Utilizzare un disinfettante adatto per disinfettare la pelle.

3 - Rimuovere il cappuccio protettivo dall'ago. Tirare il cappuccio invece di torcerlo.
4 - Pizzicare delicatamente la pelle attorno all'area disinfettata (per sollevarla leggermente).

5 - Inserire l'ago direttamente nella pelle con un angolo di 90° con un movimento deciso e sicuro. Tieni la siringa come una matita o
dardo.
6 - Iniettare lentamente la soluzione, spingendo delicatamente e continuamente lo stantuffo. (Premere lo stantuffo fino in fondo finché la siringa non è vuota).
7- Gettare la siringa in un contenitore per rifiuti.
- Rotazione dei siti di iniezione
Ogni volta deve essere selezionato un nuovo sito di iniezione, poiché l'alternanza dei siti di iniezione consente alla pelle di guarire e aiuta anche a prevenire l'infezione. È meglio scegliere in anticipo il sito di iniezione e solo successivamente preparare la siringa. Lo schema mostrato nella figura ti aiuterà a alternare correttamente i siti di iniezione. Ad esempio, se hai fatto la prima iniezione nella metà destra dell'addome, fai la seconda metà sinistra, il terzo - nella coscia destra, ecc. secondo lo schema fino a quando non avrà utilizzato tutti i possibili siti di iniezione. Registra dove e quando hai fatto l'ultima iniezione.


Seguendo lo schema proposto, dopo l'ottava iniezione (dopo 16 giorni), ritornerà al sito della prima iniezione (ad esempio, il lato destro dell'addome). Questo è chiamato il "ciclo di alternanza". Nel nostro diagramma di esempio, ciascuna zona è a sua volta suddivisa in 6 siti di iniezione (per un totale di 48 siti di iniezione): sinistra e destra, superiore, centrale e inferiore della rispettiva area. Quando, dopo una rotazione, ritorna in una delle zone, scelga il sito di iniezione più distante in questa zona. Se una qualsiasi area diventa dolorosa, discuta con il medico di altri possibili siti di iniezione.
Schema di interlacciamento:
Per aiutarti a ruotare correttamente i siti di iniezione, si consiglia di annotare quando e dove è stata praticata l'iniezione. Per fare ciò, è possibile utilizzare il seguente schema di interleaving:
1° cicloalternanza Le prime 8 iniezioni vengono effettuate in sequenza dalla 1a zona all'8a zona, utilizzando solo il segmento superiore sinistro di ciascuna zona.
2° cicloalternanza Le successive 8 iniezioni ricominciano dalla 1a zona, ma devono essere effettuate nel segmento in basso a destra di ciascuna zona.
3° cicloalternanza Le successive 8 iniezioni di questo ciclo iniziano dalla 1a zona e vengono eseguite a turno nei segmenti centrali di sinistra di ciascuna zona.
Se si segue questa sequenza, ciascuna zona avrà l'opportunità di recuperare completamente prima dell'iniezione successiva.
Registrazione delle iniezioni eseguite
Istruzioni per la registrazione dei luoghi e delle date delle iniezioni effettuate
Scegli un sito di iniezione. Se stai già utilizzando Betaferon, inizia con la zona che non è stata utilizzata durante l'ultimo ciclo di alternanza, ad es. negli ultimi 16 giorni.
Dopo l'iniezione, annotare il sito utilizzato e la data dell'iniezione (vedere la figura “Esempio di registrazione delle iniezioni eseguite” alla fine delle istruzioni per l'uso).


EFFETTO COLLATERALE
Il verificarsi di reazioni avverse di solito accompagna l'inizio della terapia. La loro frequenza diminuisce nel tempo.
Il più comune complesso di sintomi simil-influenzali (febbre, brividi, artralgia, malessere generale, sudorazione, mal di testa o mialgia) può verificarsi a causa di azione farmacologica droga Betaferon. Si raccomanda di titolare la dose all'inizio del trattamento. La gravità dei sintomi simil-influenzali può essere ridotta utilizzando farmaci antinfiammatori non steroidei.
Spesso, i pazienti dopo l'introduzione del farmaco Betaferon alla dose di 0,25 mg (8 milioni di UI) manifestano reazioni nel sito di iniezione (ad esempio, arrossamento, gonfiore, scolorimento della pelle, infiammazione, dolore, ipersensibilità, necrosi e non- reazioni specifiche).
La frequenza delle reazioni nel sito di iniezione può essere ridotta utilizzando un dispositivo per la somministrazione automatica del farmaco.
Di seguito sono presentate le reazioni avverse (AR) con l'uso del farmaco Betaferon, osservate nel corso di studi clinici e identificate nel processo di osservazione post-registrazione, e la frequenza del loro verificarsi.
Il termine più appropriato del Dizionario medico per le attività di regolamentazione (MedDRA) è usato per descrivere la reazione specifica, i suoi sinonimi e le condizioni correlate.
Tabella 1: Eventi avversi e deviazioni dei parametri di laboratorio, osservato durante test clinici con un tasso di occorrenza ≥ 10% e una sindrome comprendente almeno due dei seguenti eventi avversi:
febbre, brividi, mialgia, malessere e sudorazione;
3 - deviazione dalla norma dei parametri di laboratorio;
4
Betaferon in pazienti con una sindrome clinicamente isolata, permettendo
suggeriscono la sclerosi multipla, p< 0,05;
5
- eventi avversi, in gran parte associati all'uso del farmaco
Betaferon in pazienti con sclerosi multipla recidivante-remittente,
P< 0,05;
6
- eventi avversi, in gran parte associati all'uso del farmaco
Betaferon in pazienti con sclerosi multipla secondaria progressiva, p< 0,05;
7
- non sono stati osservati cambiamenti nel profilo durante lo studio clinico BENEFIT
sicurezza di Betaferon.
Tavolo 2: Le reazioni avverse identificate durante le osservazioni post-registrazione, e per le quali è stabilita la frequenza di occorrenza, sono determinate sulla base dei dati raccolti dagli studi clinici (
3 - si riferisce a tutti i preparati contenenti interferone (vedere quanto segue
Betaferon è un farmaco utilizzato nel trattamento della sclerosi multipla.
Forma e composizione del rilascio
Betaferon è prodotto sotto forma di liofilizzato bianco, con un solvente incolore trasparente attaccato nel kit, rispettivamente in flaconcini di vetro da 9,6 milioni UI e 1,2 siringhe. La soluzione finita ha l'aspetto di un liquido giallo chiaro o incolore leggermente opalescente.
Un flacone di Betaferon contiene 9,6 milioni di UI di interferone beta-1b ricombinante ei seguenti eccipienti: mannitolo e albumina umana. La composizione del solvente include una soluzione sterile di cloruro di sodio allo 0,54%.
Indicazioni per l'uso
In conformità con le istruzioni, Betaferon è prescritto per il trattamento di una sindrome clinicamente isolata, riducendo la gravità dell'esacerbazione e la frequenza della sclerosi multipla recidivante-remittente e della sclerosi multipla progressiva secondaria.
Controindicazioni
L'uso di Betaferon è controindicato durante la gravidanza, così come nei casi di ipersensibilità del paziente a qualsiasi componente del farmaco e durante il periodo dell'allattamento al seno.
Con cautela, il farmaco viene prescritto per violazioni della funzionalità epatica, una storia di crisi epilettiche, malattie cardiache, anemia, depressione, trombocitopenia, pensieri suicidi e pazienti di età inferiore ai 18 anni.
Metodo di applicazione e dosaggio
Il farmaco viene somministrato per via sottocutanea sotto la supervisione di un medico. Il dosaggio dell'agente è di 250 mcg, che corrisponde a un ml della soluzione finita. Le iniezioni vengono somministrate rigorosamente una volta ogni 48 ore La durata della terapia con Betaferon è determinata dal medico in individualmente e può durare dai 3 ai 5 anni.
Effetti collaterali
Se utilizzato, Betaferon può causare effetti collaterali da alcuni sistemi del corpo, vale a dire:
- Ipertensione arteriosa, tachicardia, vasodilatazione, cardiomiopatia e palpitazioni (sistema cardiovascolare);
- Dolore addominale, nausea, pancreatite, vomito, aumento dell'attività dell'aspartato aminotransferasi e dell'alanina aminotransferasi, epatite e diarrea (apparato digerente);
- Linfocitopenia, anemia, neutropenia, leucopenia, trombocitopenia e linfoadenopatia (sistema ematopoietico);
- Miastenia grave, artralgia, mialgia e crampi alle gambe (sistema muscolo-scheletrico);
- Mancanza di respiro e broncospasmo (sistema respiratorio);
- Bisogno imperativo di urinare (sistema urinario);
- Metrorragia, menorragia, disturbi mestruali e impotenza (sistema riproduttivo);
- Funzione compromessa ghiandola tiroidea, ipertiroidismo e ipotiroidismo (sistema endocrino);
- Aumento dei livelli di trigliceridi (metabolismo).
Inoltre, secondo le istruzioni, Betaferon provoca i seguenti effetti collaterali e reazioni:
- insonnia, vertigini, ipertono muscolare, anoressia, tentativi di suicidio, depressione, agitazione, confusione, labilità emotiva e incoordinazione (sistema nervoso centrale);
- Reazioni anafilattiche ( reazioni allergiche);
- Iperemia, edema locale, infiammazione, dolore e necrosi nel sito di iniezione (reazioni locali);
- Alopecia, orticaria, eruzione cutanea, prurito e scolorimento della pelle (reazioni dermatologiche);
- Astenia, mal di testa, malessere generale, febbre, dolori addominali e toracici, brividi e sintomi simil-influenzali (tutto il corpo).
istruzioni speciali
Immediatamente prima dell'inizio della terapia, nonché regolarmente durante l'intero periodo di utilizzo di Betaferon, si raccomanda di eseguire un esame del sangue dettagliato e monitorare la funzionalità epatica. Nei casi in cui viene rilevato un aumento significativo delle transaminasi epatiche, il farmaco deve essere interrotto.
È importante informare i pazienti che Betaferon può causare effetti indesiderati quali pensieri suicidari e depressione.
Il farmaco provoca effetti avversi dal sistema nervoso centrale, quindi i pazienti devono prestare attenzione durante la somministrazione meccanismi complessi e veicoli.
Il farmaco in uno stato diluito deve essere usato immediatamente.
Analoghi
Un sinonimo per il farmaco è il farmaco Betfer-1B. Gli analoghi di Betaferon sono farmaci come:
- Alfarekin;
- Bioferone;
- Virogel;
- Genfaxon;
- Ingaro;
- Laferobione;
- Nazoferone;
- Pegintron;
- Realdiron;
- Ceferon;
- Eberon Alfa R;
- Unitron.
Termini e condizioni di conservazione
Betaferon, secondo le istruzioni, deve essere conservato in un luogo asciutto, fuori dalla portata dei bambini e leggero, ad una temperatura variabile tra i 15-25°C.
Il farmaco viene rilasciato dalle farmacie su prescrizione medica. La durata di conservazione del farmaco è di due anni. Dopo la data di scadenza, il medicinale deve essere smaltito. Il solvente viene conservato per tre anni.
Betaferon- il primo farmaco sviluppato appositamente per il trattamento della sclerosi multipla e registrato solo per questa indicazione.
Sia nella sclerosi multipla recidivante che in quella secondaria progressiva, il trattamento con Betaferon riduce la frequenza (del 30%) e la gravità delle riacutizzazioni cliniche della malattia, il numero di ricoveri e la necessità di trattamento con glucocorticosteroidi e prolunga anche la durata della remissione.
Nei pazienti con SM secondaria progressiva, il trattamento con Betaferon può ritardare l'ulteriore progressione della malattia e l'insorgenza di disabilità, anche grave (cioè quando i pazienti sono costretti a utilizzare costantemente una sedia a rotelle) fino a 12 mesi. Questo effetto è stato osservato in pazienti sia con esacerbazioni della malattia che senza esacerbazioni, nonché con qualsiasi indice di disabilità (hanno partecipato allo studio pazienti con un punteggio compreso tra 3,0 e 6,5 punti sulla scala estesa di valutazione dello stato di disabilità).
I risultati della risonanza magnetica del cervello di pazienti con sclerosi multipla recidivante e secondaria progressiva durante il trattamento con Betaferon confermano un significativo effetto positivo del farmaco sulla gravità del processo patologico, nonché una significativa diminuzione della formazione di nuovi attivi fuochi.
Proprietà farmacologiche
Farmacodinamica. Il principio attivo del farmaco Betaferon (interferone beta-lb) ha attività antivirale e immunomodulante. I meccanismi d'azione dell'interferone beta-1b nella sclerosi multipla (SM) non sono stati completamente stabiliti. Tuttavia, è noto che l'effetto biologico dell'interferone beta-1b è mediato dalla sua interazione con specifici recettori presenti sulla superficie delle cellule umane. Il legame dell'interferone beta-1K a questi recettori induce l'espressione di una serie di sostanze che sono considerate mediatori degli effetti biologici dell'interferone beta-1K Istruzioni per l'uso: alcune di queste sostanze sono state determinate nelle frazioni sieriche ed ematiche di pazienti trattati con interferone beta-1K capacità del recettore dell'interferone gamma e ne aumenta l'interiorizzazione e la degradazione. Inoltre, l'interferone beta-1b aumenta l'attività di soppressione delle cellule mononucleate del sangue periferico.
Non sono stati condotti studi di tossicità acuta. Poiché i roditori sono insensibili agli effetti dell'interferone beta umano, la valutazione del rischio si è basata su studi di tossicità a dosi ripetute nelle scimmie rhesus. È stata osservata ipertermia transitoria, insieme a un pronunciato aumento transitorio della concentrazione dei linfociti e una diminuzione transitoria delle piastrine e dei neutrofili segmentati.
Non sono stati condotti studi di tossicità a lungo termine. Studi sulla tossicità riproduttiva nelle scimmie rhesus hanno mostrato tossicità materna e un aumento dei tassi di aborto spontaneo. Non sono state osservate malformazioni nella prole vivente. Non sono stati condotti studi sull'effetto sulla fertilità. Non è stato osservato alcun effetto sul ciclo estrale della scimmia.
In uno studio separato sulla genotossicità (test di Ames), non sono stati osservati effetti mutageni. Non sono stati condotti studi di cancerogenicità. Un test di trasformazione cellulare in vitro non ha rivelato alcun potenziale cancerogeno.
Farmacocinetica. Dopo somministrazione sottocutanea di Betaferon alla dose raccomandata di 0,25 mg, le concentrazioni sieriche di interferone beta-1b sono basse o non vengono rilevate affatto. A questo proposito, non ci sono informazioni sulla farmacocinetica del farmaco nei pazienti con sclerosi multipla trattati con Betaferon alla dose raccomandata. Dopo somministrazione sottocutanea di 0,5 mg di Betaferon, la concentrazione plasmatica massima viene raggiunta 1-8 ore dopo l'iniezione ed è di circa 40 UI/ml. La biodisponibilità assoluta di Betaferon quando somministrato per via sottocutanea è di circa il 50%. Con la somministrazione endovenosa di interferone beta-1b, la clearance e l'emivita del farmaco dal siero sono in media rispettivamente di 30 ml/min/kg e 5 ore.
L'introduzione di Betaferon a giorni alterni non porta ad un aumento della concentrazione di interferone beta-lb nel plasma sanguigno e la sua farmacocinetica durante il corso della terapia non cambia.
Con applicazione sottocutanea di Betaferon alla dose di 0,25 mg a giorni alterni Istruzioni per l'uso: marcatori di risposta biologica (neopterina, beta2-microglobulina e citochina immunosoppressiva, interleuchina-10) aumentano significativamente rispetto ai valori basali 6-12 ore dopo la prima dose del farmaco. Hanno raggiunto il picco a 40-124 ore e sono rimasti elevati per tutto il periodo di studio di 7 giorni (168 ore).
Indicazioni per l'uso di Betaferon
Sindrome clinicamente isolata (CIS) (l'unico episodio clinico di demielinizzazione indicativo di sclerosi multipla, a condizione che siano escluse diagnosi alternative) con sufficiente infiammazione da richiedere corticosteroidi per via endovenosa per rallentare la progressione verso la sclerosi multipla clinicamente significativa (CRMS) in pazienti ad alto rischio KDRS.
Non esiste una definizione generalmente accettata di rischio elevato. Secondo lo studio, i pazienti con CIS monofocale (manifestazioni cliniche di 1 lesione nel sistema nervoso centrale) e > 9 focolai T2 alla risonanza magnetica e/o focolai che accumulano un mezzo di contrasto appartengono al gruppo ad alto rischio di sviluppare CRMS. I pazienti con CIS multifocale (manifestazioni cliniche di >1 lesione nel sistema nervoso centrale) sono ad alto rischio di sviluppare CRMS, indipendentemente dal numero di focolai alla RM.
Sclerosi multipla recidivante-remittente (RRMS) - per ridurre la frequenza e la gravità delle riacutizzazioni nei pazienti ambulatoriali (cioè pazienti in grado di camminare senza assistenza) con una storia di almeno 2 riacutizzazioni negli ultimi 2 anni, seguite da recupero completo o incompleto della malattia neurologica disavanzo.
Sclerosi multipla secondaria progressiva con un decorso attivo della malattia, caratterizzato da esacerbazioni o grave deterioramento delle funzioni neurologiche negli ultimi due anni - per ridurre la frequenza e la gravità delle esacerbazioni cliniche della malattia, nonché per rallentare il tasso di progressione di la malattia
Dosaggio e somministrazione
Il trattamento con Betaferon deve essere iniziato sotto la supervisione di un medico esperto nel trattamento della sclerosi multipla. Attualmente, la questione della durata della terapia con Betaferon rimane irrisolta. Negli studi clinici, la durata del trattamento nei pazienti con sclerosi multipla recidivante-remittente e secondaria progressiva ha raggiunto rispettivamente 5 e 3 anni. La durata del corso è determinata dal medico.
Preparazione della soluzione per iniezione
A. Confezione del prodotto contenente flaconcini e siringhe preriempite: utilizzare la siringa di solvente preconfezionata e l'ago forniti per sciogliere la polvere iniettabile di interferone beta-1b liofilizzato.
B. Confezione del prodotto contenente flaconcini, siringhe preriempite, adattatore per flaconcino con ago e salviettine imbevute di alcol: utilizzare la siringa di diluente preconfezionata e l'adattatore per flaconcino con ago forniti per sciogliere la polvere iniettabile di interferone beta-1b liofilizzato.
1,2 ml di un solvente (soluzione di cloruro di sodio allo 0,54%) vengono iniettati in un flacone con Betaferon. La polvere dovrebbe dissolversi completamente senza agitare. Prima dell'uso, ispezionare la soluzione finita. In presenza di particelle o di un cambiamento nel colore della soluzione, non deve essere utilizzato. 1 ml della soluzione preparata contiene 0,25 mg (8 milioni di UI) di interferone beta-lb.
La dose raccomandata di Betaferon 0,25 mg (8 milioni UI), contenuta in 1 ml della soluzione preparata, viene somministrata per via sottocutanea a giorni alterni. Se hai dimenticato di fare un'iniezione all'ora prevista, devi iniettarti il farmaco non appena te ne ricordi. L'iniezione successiva viene effettuata dopo 48 ore.
Caratteristiche dell'applicazione
Questo medicinale contiene albumina umana e pertanto esiste un rischio di trasmissione molto basso malattie virali. Anche il rischio teorico di trasmissione della malattia di Creutzfeldt-Jakob è considerato altamente improbabile.
Cambiamenti nei parametri di laboratorio
Oltre ai test di laboratorio standard prescritti nella gestione dei pazienti con sclerosi multipla, prima di iniziare la terapia con Betaferon, nonché regolarmente durante il trattamento, si raccomanda di eseguire un esame del sangue dettagliato, compresa la determinazione della conta leucocitaria, conta piastrinica e analisi biochimica sangue e controllare la funzionalità epatica (p. es., l'attività dell'aspartato aminotransferasi (AST), dell'alanina aminotransferasi (ALT) e della gamma-glutamiltransferasi (γ-GT)). Quando si gestiscono pazienti con anemia, trombocitopenia, leucopenia (singolarmente o in combinazione), può essere necessario un monitoraggio più attento di un emocromo completo, compresa la determinazione del numero di globuli rossi, globuli bianchi, piastrine e formula leucocitaria.
Disordini gastrointestinali
In rari casi, sullo sfondo dell'uso di Betaferon, è stato osservato lo sviluppo di pancreatite, nella maggior parte dei casi associata alla presenza di ipertrigliceridemia.
Patologie del fegato e delle vie biliari
Studi clinici hanno dimostrato che la terapia con Betaferon può spesso portare ad un aumento asintomatico dell'attività delle transaminasi "fepatiche", che nella maggior parte dei casi è lieve e transitorio. Come con altri interferoni beta, gravi lesioni fegato (compreso insufficienza epatica) quando si utilizza Betaferon sono raramente osservati. I casi più gravi sono stati riportati in pazienti esposti a farmaci o sostanze epatotossiche, così come in alcuni comorbidità(ad esempio, neoplasie maligne con metastasi, infezioni gravi e sepsi, abuso di alcool).
Durante il trattamento con Betaferon, è necessario monitorare la funzionalità epatica (compresa la valutazione quadro clinico). Un aumento dell'attività delle transaminasi nel siero del sangue richiede un attento monitoraggio ed esame. Con un aumento significativo dell'attività delle transaminasi nel siero del sangue o la comparsa di segni di danno epatico (ad esempio ittero), il farmaco deve essere interrotto. Con assenza Segni clinici danno epatico o dopo la normalizzazione dell'attività degli enzimi "epatici", è possibile riprendere la terapia con Betaferon con monitoraggio della funzionalità epatica.
Disturbi endocrini
Si consiglia ai pazienti con disfunzione tiroidea di controllare regolarmente la funzione tiroidea (ormoni tiroidei, ormone stimolante la tiroide) e, in altri casi, secondo indicazioni cliniche.
Malattie del sistema cardiovascolare
Betaferon deve essere usato con cautela nei pazienti con malattie cardiache, in particolare con insufficienza cardiaca in stadio III-IV secondo la classificazione della New York Heart Association (NYHA), poiché tali pazienti non sono stati inclusi negli studi clinici. Se la cardiomiopatia si sviluppa durante il trattamento con Betaferon e si presume che ciò sia dovuto all'uso del farmaco, il trattamento con Betaferon deve essere interrotto.
Malattie del sistema nervoso
I pazienti devono essere informati che un effetto collaterale di Betaferon può essere depressione e pensieri suicidi, la cui comparsa deve consultare immediatamente un medico. In due studi clinici controllati che hanno coinvolto 1657 pazienti con SM secondaria progressiva, non sono state riscontrate differenze significative nell'incidenza di depressione e pensieri suicidari durante l'utilizzo di Betaferon o del placebo. Tuttavia, si deve usare cautela quando si prescrive Betaferon a pazienti con disturbi depressivi e storia di pensieri suicidi. Se tali fenomeni si verificano durante il trattamento, deve essere considerata la questione dell'opportunità di annullare Betaferon. Betaferon deve essere usato con cautela nei pazienti con anamnesi di convulsioni.
Disturbi generali e disturbi al sito di iniezione
Possono verificarsi gravi reazioni allergiche (rare, ma acute e gravi, come broncospasmo, anafilassi e orticaria). Se vi sono segni di danni all'integrità della pelle (ad esempio, il deflusso di liquidi dal sito di iniezione), il paziente deve consultare un medico prima di continuare a eseguire iniezioni di Betaferon. Nei pazienti trattati con Betaferon sono stati osservati casi di necrosi al sito di iniezione (vedere "Effetti collaterali"). La necrosi può essere estesa ed estendersi alla fascia muscolare così come al tessuto adiposo e di conseguenza portare alla cicatrizzazione. In alcuni casi è necessaria la rimozione della pelle morta o, meno comunemente, l'innesto cutaneo. Il processo di guarigione può richiedere fino a 6 mesi.
Quando compaiono più focolai di necrosi, il trattamento con Betaferon deve essere interrotto fino alla completa guarigione delle aree danneggiate. In presenza di un focolaio, se la necrosi non è troppo estesa, l'uso di Betaferon può essere continuato, poiché in alcuni pazienti la guarigione dell'area morta nel sito di iniezione si è verificata durante l'uso di Betaferon. Per ridurre il rischio di sviluppare una reazione e necrosi nel sito di iniezione, i pazienti devono essere avvisati di:
- effettuare iniezioni, osservando rigorosamente le regole dell'asepsi;
- cambiare ogni volta il sito di iniezione;
- iniettare il farmaco rigorosamente per via sottocutanea.
Periodicamente, la correttezza dell'autoiniezione deve essere monitorata, specialmente quando compaiono reazioni locali.
Anticorpi neutralizzanti
Come nel trattamento di qualsiasi altro farmaco con istruzioni per l'uso: proteina m, quando si utilizza Betaferon, esiste la possibilità di formazione di anticorpi. In una serie di studi clinici controllati, il siero del sangue è stato analizzato ogni 3 mesi per rilevare la formazione di anticorpi contro Betaferon. In questi studi, è stato dimostrato che gli anticorpi neutralizzanti contro l'interferone beta-lb si sono sviluppati nel 23%-41% dei pazienti, il che è stato confermato da almeno due successivi risultati positivi di test di laboratorio. Nel 43%-55% di questi pazienti, successivi ricerca di laboratorioè stata rilevata un'assenza stabile di anticorpi contro l'interferone beta-lb.
In uno studio condotto su pazienti con una sindrome clinicamente isolata indicativa di sclerosi multipla, l'attività neutralizzante, misurata ogni 6 mesi, è stata osservata durante le visite corrispondenti nel 16,5-25,2% dei pazienti trattati con Betaferon. L'attività neutralizzante è stata rilevata almeno una volta nel 30% (75) dei pazienti trattati con Betaferon; nel 23% (17) di essi, prima che lo studio fosse completato, lo stato anticorpale tornava ad essere negativo. Durante il periodo di due anni dello studio, lo sviluppo dell'attività neutralizzante non è stato associato ad una diminuzione dell'efficacia clinica (in termini di tempo all'insorgenza di sclerosi multipla clinicamente significativa).
Non è stato dimostrato che la presenza di anticorpi neutralizzanti abbia effetti significativi sugli esiti clinici. Lo sviluppo dell'attività neutralizzante non era associato alla comparsa di nessuno reazioni avverse. La decisione di continuare o interrompere la terapia dovrebbe basarsi sugli indicatori dell'attività clinica della malattia e non sullo stato dell'attività neutralizzante.
disturbi immunitari
L'uso di citochine in pazienti con gammopatia monoclonale è stato talvolta accompagnato da un aumento sistemico della permeabilità capillare con lo sviluppo di shock e morte.
Uso nei bambini
Non è stato condotto uno studio sistematico sull'efficacia e la sicurezza di Betaferon nei bambini e negli adolescenti sotto i 18 anni di età.
Influenza sulla capacità di guidare un'auto e lavorare con i meccanismi
Non sono stati condotti studi speciali. Gli eventi avversi dal lato del sistema nervoso centrale possono influire sulla capacità di guidare un'auto e lavorare con i meccanismi. A questo proposito, è necessario prestare attenzione quando si intraprendono attività potenzialmente pericolose che richiedono maggiore attenzione.
Effetti collaterali
Di seguito sono riportati gli eventi avversi osservati con una frequenza del 2% e superiore rispetto al gruppo placebo (farmaco inattivo) nei pazienti che hanno ricevuto Betaferon alla dose di 0,25 mg o 0,16 mg/m2 a giorni alterni per un massimo di tre anni durante la clinica studi. I sintomi simil-influenzali possono essere alleviati con l'uso di farmaci antinfiammatori non steroidei. L'esperienza nell'uso di Betaferon per il trattamento di pazienti con sclerosi multipla è piuttosto limitata, pertanto, le reazioni avverse che si verificano con una bassa frequenza potrebbero non essere ancora osservate. Il termine più appropriato del Dizionario medico per le attività di regolamentazione (MedDRA) è usato per descrivere la reazione specifica, i suoi sinonimi e le condizioni correlate.
Reazioni generali: reazione al sito di iniezione, astenia (debolezza), un complesso di sintomi simil-influenzali, mal di testa, febbre, brividi, edema periferico, dolore toracico, dolore di varia localizzazione, malessere generale, necrosi al sito di iniezione.
Sistema cardiovascolare: Migliora pressione sanguigna.
Apparato digerente: dolori addominali.
Sangue e sistema linfatico: Linfocitopenia inferiore a 1500/mm3, neutropenia inferiore a 1500/mm3, leucopenia inferiore a 3000/mm3. Linfoadenopatia.
Disturbi metabolici e alimentari: Aumento dell'attività degli enzimi nel sangue: aspartato aminotransferasi (AST) 5 volte dal valore iniziale, alanina aminotransferasi (ALT) 5 volte dal valore iniziale.
Sistema muscoloscheletrico: miastenia grave, mialgia, crampi alle gambe.
Sistema nervoso: insonnia, compromissione della coordinazione.
Apparato respiratorio: Respiro affannoso.
Pelle: eruzioni cutanee, lesioni cutanee.
Sistema genito-urinario: bisogno imperativo di urinare, nelle donne - metrorragia (aciclico sanguinamento uterino), negli uomini - impotenza.
L'elenco qui sotto effetti collaterali sulla base dell'osservazione post-marketing dell'uso di Betaferon.
Reazioni generali: Molto comuni: sintomi simil-influenzali (febbre, brividi, mialgia, mal di testa o sudorazione eccessiva)*. La frequenza di questi sintomi diminuisce nel tempo. Raro: malessere generale, dolore toracico, perdita di peso, aumento di peso.
Reazioni locali: Molto spesso: reazioni al sito di iniezione (iperemia, edema locale), infiammazione, dolore. Spesso: necrosi al sito di iniezione. Nel corso del tempo, con la prosecuzione del trattamento, la frequenza delle reazioni nel sito di iniezione di solito diminuisce.
Sangue e sistema linfatico: raramente: anemia, trombocitopenia, leucopenia. Raro: linfoadenopatia.
Patologie endocrine: Raro: disfunzione tiroidea, incluso ipertiroidismo, ipotiroidismo.
Disturbi metabolici: Raramente: un aumento della concentrazione di trigliceridi.
Sistema nervoso: raramente: ipertonicità muscolare, depressione. Rari: convulsioni, confusione, agitazione, labilità emotiva, tentativi di suicidio, anoressia, vertigini.
Sistema cardiovascolare: raramente: aumento della pressione sanguigna. Raro: cardiomiopatia, tachicardia, forte battito cardiaco. Molto raro: vasodilatazione.
Organi respiratori: Raro: mancanza di respiro, broncospasmo.
Tratto gastrointestinale: Non comune: nausea e vomito. Raro: pancreatite, diarrea.
Fegato e vie biliari: Raramente: aumento dell'attività di AST, ALT. Raramente: aumento dell'attività della gamma-glutamil transferasi, concentrazione di bilirubina, epatite.
Pelle e tessuto sottocutaneo: Non comune: alopecia, orticaria, prurito cutaneo, eruzioni cutanee. Raro: scolorimento della pelle.
Muscoli scheletrici: Non comune: mialgia. Raro: artralgia.
Sistema riproduttivo femminile: Raro: irregolarità mestruali. Molto raro: menorragia (sanguinamento mestruale prolungato).
Reazioni allergiche: Raro: reazioni anafilattiche.
Interazione con altri farmaci
Non sono stati condotti studi speciali sull'interazione di Betaferon con altri farmaci. L'effetto dell'uso di Betaferon alla dose di 0,25 mg (8 milioni di UI) a giorni alterni sul metabolismo medicinali nei pazienti con sclerosi multipla non è noto. Sullo sfondo dell'uso di Betaferon, i glucocorticosteroidi e l'ACTH, prescritti per un massimo di 28 giorni nel trattamento delle riacutizzazioni, sono ben tollerati. L'uso concomitante di Betaferon con altri immunomodulatori, oltre ai corticosteroidi o all'ACTH, non è stato studiato. Gli interferoni riducono l'attività degli enzimi dipendenti dal citocromo epatico P450 nell'uomo e negli animali.Deve essere prestata attenzione quando si prescrive Betaferon in combinazione con farmaci che hanno un indice terapeutico ristretto, la cui clearance dipende in gran parte dal sistema del citocromo P450 epatico (ad esempio , farmaci antiepilettici, antidepressivi). Bisogna fare attenzione anche con l'uso simultaneo di eventuali farmaci che influenzano il sistema ematopoietico. A causa della mancanza di studi di compatibilità, questo farmaco non deve essere miscelato con altri farmaci.
Controindicazioni
- Gravidanza.
- Allattamento.
- Storia di reazioni di ipersensibilità all'interferone-beta naturale o ricombinante o all'albumina umana.
Betaferon deve essere usato con cautela nei pazienti con le seguenti condizioni:
- malattie cardiache, in particolare, insufficienza cardiaca stadio III-IV secondo la classificazione della New York Heart Association (NYHA), cardiomiopatia;
- depressione e pensieri suicidi (compresa la storia), crisi epilettiche nella storia;
- gammopatia monoclonale;
- anemia, trombocitopenia, leucopenia;
- disfunzione epatica.
A causa della mancanza di sufficiente esperienza d'uso, è necessaria cautela quando viene utilizzato in pazienti di età inferiore ai 18 anni.
Gravidanza. Non è noto se Betaferon possa causare danno fetale se trattato in donne in gravidanza o influire sulla funzione riproduttiva umana. In studi clinici controllati su pazienti con sclerosi multipla, si sono verificati casi di aborto spontaneo. Negli studi sulle scimmie rhesus, l'interferone beta-I umano ha avuto un effetto embriotossico e altro ancora alte dosi causato un aumento del tasso di aborti. Le donne in età riproduttiva dovrebbero usare metodi contraccettivi affidabili durante l'assunzione di questo farmaco. In caso di gravidanza durante il trattamento con Betaferon o durante la pianificazione di una gravidanza, si raccomanda di sospendere l'assunzione del farmaco.
Allattamento. Non è noto se l'interferone beta-1b sia escreto nel latte materno. Data la possibilità teorica di sviluppare reazioni avverse a Betaferon nei bambini allattati al seno, è necessario interrompere l'allattamento al seno o sospendere il farmaco.
Controindicato in gravidanza (può causare morte fetale o causare malformazioni congenite). Al momento del trattamento dovrebbe interrompere l'allattamento al seno.
Overdose
Con l'introduzione di Betaferon per via endovenosa a una dose fino a 5,5 mg (176 milioni di UI) tre volte alla settimana in pazienti adulti affetti da cancro, non sono stati rilevati eventi avversi gravi.
