سنتز نمک های آمونیوم در کلیه ها
در کلیه ها، تحت اثر آنزیم فعال گلوتامیناز، تجزیه هیدرولیتیک گلوتامین به اسید گلوتامیک و آمونیاک رخ می دهد.
در کلیه ها، هنگامی که پروتون ها دفع می شوند، بازجذب همزمان یون های Na + و K + وجود دارد. بنابراین، گلوتامیناز کلیه در تنظیم تعادل اسید و باز نقش دارد.
فعالیت گلوتامیناز وابسته به pH است. با اسیدوز، فعالیت آنزیم افزایش می یابد که باعث افزایش دفع پروتون ها و کاهش درجه اسیدوز می شود.
در بزرگسالان، 0.5-1.2 گرم نمک آمونیوم در روز آزاد می شود. آنها 3.5 درصد از نیتروژن دفع شده را تشکیل می دهند. در کودکاننسبت نسبی نمک های آمونیوم بیشتر از بزرگسالان است. در نوزادان، نیتروژن نمک های آمونیوم تا 8.5٪ است.
بیوسنتز اوره و موارد نقض آن
گلوتامین وارد کبد می شود و در آنجا تحت تأثیر آنزیم گلوتامیناز، آمونیاک آزاد می شود که به اوره تبدیل می شود. اسید آمینه اورنیتین در سنتز اوره نقش دارد، بنابراین سنتز اوره نامیده می شود. چرخه اورنیتین

محل اصلی سنتز اوره کبد است.
آنزیم های کلیدی برای بیوسنتز اوره عبارتند از کاربامویل فسفات سنتتاز، ارتینی کاربامویل ترانسفراز و آرژیناز. منابع نیتروژن در اوره آمونیاک و اسید آسپارتیک هستند. چرخه اورنیتین ارتباط نزدیکی با چرخه کربس دارد. اسید فوماریک از چرخه اورنیتین به چرخه کربس "برگ" می کند. چرخه اسید تری کربوکسیلیک به نوبه خود چرخه اورنیتین را با مولکول های ATP فراهم می کند.



ویژگی های دفع فرآورده های نیتروژن دار نهایی در کودکان
در دوران کودکی ممکن است وجود داشته باشد اختلالات سنتز اوره،که منجر به افزایش غلظت آمونیاک در خون و بافت ها می شود. آنها با استفراغ، تشنج پس از خوردن غذاهای پروتئینی ظاهر می شوند. علائم مسمومیت با تغذیه پروتئینی کسری کاهش می یابد. اختلالات تشکیل اوره با فقدان یا فعالیت کم آنزیم های دخیل در این فرآیند همراه است.
آفرمانتوزهای بیوسنتز اوره
یک اتصال عجیب آمونیاک در ماهیچه ها رخ می دهد - چرخه آلانین، که در نمودار ارائه شده است:

سوال کامل شد
متابولیسم نیتروژن
متابولیسم نیتروژن- مجموعه ای از دگرگونی های شیمیایی، واکنش های سنتز و تجزیه ترکیبات نیتروژنی در بدن. جزء متابولیسم و انرژی مفهوم "متابولیسم نیتروژن" شامل متابولیسم پروتئین(مجموعه ای از دگرگونی های شیمیایی در بدن پروتئین ها و محصولات متابولیکی آنها) و همچنین تبادل پپتیدها، آمینو اسید, اسیدهای نوکلئیک, نوکلئوتیدها، بازهای نیتروژنی، قندهای آمینه (نگاه کنید به. کربوهیدرات)حاوی نیتروژن لیپیدها, ویتامین ها, هورمون ها و سایر ترکیبات حاوی نیتروژن.
ارگانیسم حیوانات و انسان نیتروژن قابل هضم را از غذا دریافت می کند که منبع اصلی ترکیبات نیتروژن دار پروتئین های حیوانی و گیاهی است. عامل اصلی در حفظ تعادل نیتروژن - حالت AA که در آن مقدار نیتروژن ورودی و خروجی یکسان است - دریافت کافی پروتئین از غذا است. در اتحاد جماهیر شوروی نرخ روزانهپروتئین در رژیم غذایی یک بزرگسال برابر با 100 است جی، یا 16 جیپروتئین نیتروژن، با مصرف انرژی 2500 کیلو کالری. تعادل نیتروژن (تفاوت بین مقدار نیتروژنی که با غذا وارد بدن می شود و مقدار نیتروژن دفع شده از بدن با ادرار، مدفوع و عرق) نشان دهنده شدت A.o است. در ارگانیسم گرسنگی یا تغذیه ناکافی نیتروژن منجر به تعادل منفی نیتروژن یا کمبود نیتروژن می شود که در آن مقدار نیتروژن دفع شده از بدن از مقدار نیتروژن وارد شده به بدن با غذا بیشتر می شود. تعادل نیتروژن مثبت، که در آن مقدار نیتروژن وارد شده با غذا از مقدار نیتروژن دفع شده از بدن بیشتر است، در طول دوره رشد بدن، در طی فرآیندهای بازسازی بافت و غیره مشاهده می شود. وضعیت الف در مورد. تا حد زیادی به کیفیت پروتئین غذا بستگی دارد که به نوبه خود با ترکیب اسید آمینه آن و مهمتر از همه وجود اسیدهای آمینه ضروری تعیین می شود.
به طور کلی پذیرفته شده است که در انسان و مهره داران A. o. با هضم ترکیبات نیتروژن دار غذا در دستگاه گوارش شروع می شود. در معده، پروتئین ها با مشارکت آنزیم های پروتئولیتیک گوارشی تجزیه می شوند. تریپسین و گاستریکسین (نگاه کنید به پروتئولیز ) برای تشکیل پلی پپتیدها، الیگوپپتیدها و اسیدهای آمینه منفرد. از معده غذا وارد معده می شود دوازدههو قسمت های پایینی روده کوچک، جایی که پپتیدها تحت شکاف بیشتری قرار می گیرند که توسط آنزیم های آب پانکراس تریپسین، کیموتریپسین، و کربوکسی پپتیداز و توسط آنزیم های آب روده آمینوپپتیدازها و دی پپتیدازها کاتالیز می شود (به زیر مراجعه کنید). آنزیم ها). همراه با پپتیدها V روده کوچکپروتئین های پیچیده (مانند نوکلئوپروتئین ها) و اسیدهای نوکلئیک را تجزیه می کند. میکرو فلور روده نیز سهم قابل توجهی در تجزیه بیوپلیمرهای حاوی نیتروژن دارد. الیگوپپتیدها، اسیدهای آمینه، نوکلئوتیدها، نوکلئوزیدها و غیره در روده کوچک جذب شده، وارد خون شده و با آن در سراسر بدن حمل می شوند. پروتئینهای بافتهای بدن در فرآیند تجدید مداوم، تحت تأثیر پروتزهای بافتی (پپتیدازها و کاتپسینها) تحت پروتئولیز قرار میگیرند و محصولات تجزیه پروتئینهای بافت وارد خون میشوند. آمینو اسیدها را می توان برای سنتز جدید پروتئین ها و سایر ترکیبات (بازهای پورین و پیریمیدین، نوکلئوتیدها، پورفیرین ها و غیره)، برای انرژی (به عنوان مثال، از طریق وارد شدن به چرخه اسید تری کربوکسیلیک) استفاده کرد یا می تواند در معرض تخریب بیشتر با تشکیل محصولات نهایی A.O.، مشروط به دفع از بدن.
اسیدهای آمینه ای که به عنوان بخشی از پروتئین های غذایی هستند برای سنتز پروتئین های اندام ها و بافت های بدن استفاده می شوند. آنها همچنین در تشکیل بسیاری از ترکیبات بیولوژیکی مهم دیگر نقش دارند: نوکلئوتیدهای پورین(گلوتامین، گلیسین، آسپارتیک اسید) و نوکلئوتیدهای پیریمیدین (گلوتامین، اسید آسپارتیک)، سروتونین (تریپتوفان)، ملانین (فنیل آلپنین، تیروزین)، هیستامین (هیستیدین)، آدرنالین، نوراپی نفرین، تیرامین (تیروزین)، پلی آمین یونارین کولین (متیونین)، پورفیرین ها (گلیسین)، کراتین (گلیسین، آرژنین، متیونین)، کوآنزیم ها، قندها و پلی ساکاریدها، لیپیدها و غیره. مهمترین واکنش شیمیایی برای بدن که تقریباً تمام اسیدهای آمینه در آن شرکت می کنند، ترانس آمینواسیون است که شامل انتقال آنزیمی برگشت پذیر گروه a-amino اسیدهای آمینه به اتم a-کربن اسیدهای کتو یا آلدئیدها است. ترانس آمینواسیون یک واکنش اساسی در بیوسنتز اسیدهای آمینه غیر ضروری در بدن است. فعالیت آنزیم هایی که واکنش های ترانس آمیناسیون را کاتالیز می کنند آمینوترانسفرازها - ارزش بالینی و تشخیصی زیادی دارد.
تخریب اسیدهای آمینه می تواند از طریق چندین مسیر مختلف انجام شود. اکثر اسیدهای آمینه می توانند با مشارکت آنزیم های دکربوکسیلاز دکربوکسیلاسیون شوند تا آمین های اولیه را تشکیل دهند که سپس می توانند در واکنش های کاتالیز شده توسط مونوآمین اکسیداز یا دی آمین اکسیداز اکسید شوند. در طی اکسیداسیون آمین های بیوژنیک (هیستامین، سروتونین، تیرامین، اسید g-aminobutyric) اکسیدازها آلدئیدهایی را تشکیل می دهند که دچار دگرگونی های بیشتری می شوند و آمونیاک, مسیر اصلی متابولیسم بیشتر که تشکیل اوره است.
یکی دیگر از مسیرهای اصلی برای تجزیه اسیدهای آمینه، دآمیناسیون اکسیداتیو با تشکیل آمونیاک و اسیدهای کتو است. دآمیناسیون مستقیم اسیدهای آمینه L در حیوانات و انسان ها بسیار کند پیش می رود، به استثنای اسید گلوتامیک، که به شدت با مشارکت آنزیم خاص گلوتامات دهیدروژناز دآمینه می شود. ترانس آمیناسیون اولیه تقریباً تمام اسیدهای آمینه α و دآمیناسیون بیشتر اسید گلوتامیک تشکیل شده به اسید α-کتوگلوتاریک و آمونیاک مکانیسم اصلی برای دآمیناسیون اسیدهای آمینه طبیعی است.
آمونیاک محصول مسیرهای مختلف تخریب اسیدهای آمینه است که می تواند در نتیجه متابولیسم سایر ترکیبات حاوی نیتروژن نیز ایجاد شود (به عنوان مثال، در هنگام دآمیناسیون آدنین که بخشی از نیکوتین آمید آدنین دی نوکلئوتید - NAD) است. راه اصلی اتصال و خنثی سازی آمونیاک سمی در حیوانات یوروتلیک (حیواناتی که محصول نهایی A. o اوره است) به اصطلاح چرخه اوره (مترادف: چرخه اورنیتین، چرخه کربس-هنسلیت) است که در کبد رخ می دهد. . این یک توالی حلقوی از واکنش های آنزیمی است که در نتیجه اوره از مولکول آمونیاک یا نیتروژن آمید گلوتامین، گروه آمینه اسید آسپارتیک و دی اکسید کربن سنتز می شود. با مصرف روزانه 100 عدد جیپروتئین دفع روزانه اوره از بدن حدود 30 عدد است جی. در انسان و حیوانات بالاتر، راه دیگری برای خنثی کردن آمونیاک وجود دارد - سنتز آمیدهای اسیدهای دی کربوکسیلیک مارچوبه و گلوتامین از اسیدهای آمینه مربوطه. در حیوانات اوریکوتلیک (خزندگان، پرندگان)، محصول نهایی A.o. است اسید اوریک.
در نتیجه تجزیه نوکلئیک اسیدها و نوکلئوپروتئین ها در دستگاه گوارش، نوکلئوتیدها و نوکلئوزیدها تشکیل می شوند. الیگو و مونوکلئوتیدها با مشارکت آنزیم های مختلف (استرازها، نوکلئوتیدازها، نوکلئوزیدازها، فسفوریلازها) سپس به بازهای پورین و پیریمیدین آزاد تبدیل می شوند.
مسیر بعدی تخریب پایه های پورینی آدنین و گوانین شامل دآمیناسیون هیدرولیتیک آنها تحت تأثیر آنزیم های آدناز و گواناز با تشکیل هیپوگزانتین (6-هیدروکسی پورین) و گزانتین (2،6-دیوکسی پورین) است که سپس در واکنش هایی که توسط گزانتین اکسیداز کاتالیز می شوند به اسید اوریک تبدیل می شوند. اسید اوریک یکی از محصولات نهایی A.o است. و محصول نهایی متابولیسم پورین در انسان - با ادرار از بدن دفع می شود. اکثر پستانداران دارای آنزیم اوریکاز هستند که تبدیل اسید اوریک به آلانتوئین دفع شده را کاتالیز می کند.
تخریب بازهای پیریمیدین (اوراسیل، تیمین) شامل کاهش آنها با تشکیل مشتقات دی هیدرولیز و متعاقب آن هیدرولیز است که در نتیجه اسید b-ureidopropionic از اوراسیل و آمونیاک، دی اکسید کربن و ب-آلانین از آن تشکیل می شود. و b-aminoisobutyric اسید از تیمین، اسید، دی اکسید کربن و آمونیاک. دی اکسید کربن و آمونیاک را می توان بیشتر از طریق چرخه اوره در اوره گنجاند و ب-آلانین در سنتز مهمترین ترکیبات بیولوژیکی فعال - دی پپتیدهای حاوی هیستیدین کارنوزین (b-alanyl-L-histidine) و آنسرین (b) نقش دارد. -آلانیل-N-متیل-L-هیستیدین) که در مواد استخراج کننده ماهیچه های اسکلتی و همچنین در سنتز اسید پانتوتنیک و کوآنزیم A یافت می شود.
بنابراین، دگرگونی های مختلف مهم ترین ترکیبات نیتروژنی بدن در یک تبادل واحد به هم متصل می شوند. فرآیند پیچیده A. o. در سطوح مولکولی، سلولی و بافتی تنظیم می شود. آیین نامه الف در مورد. در کل ارگانیسم با هدف تطبیق شدت A. o است. به شرایط متغیر محیط و محیط داخلی و توسط سیستم عصبی هم به طور مستقیم و هم با اثر بر غدد درون ریز انجام می شود.
در بزرگسالان سالم، محتوای ترکیبات نیتروژن دار در اندام ها، بافت ها و مایعات بیولوژیکی در سطح نسبتاً ثابتی است. نیتروژن اضافی غذا از طریق ادرار و مدفوع دفع می شود و با کمبود نیتروژن در غذا می توان نیاز بدن به آن را با استفاده از ترکیبات نیتروژن در بافت های بدن تامین کرد. در همان زمان، ترکیب ادرار بسته به ویژگی ها و. و تعادل نیتروژن طبیعی با رژیم غذایی بدون تغییر و شرایط نسبتاً پایدار محیطمقدار ثابتی از محصولات نهایی A. دریاچه از بدن دفع می شود و ایجاد شرایط پاتولوژیک منجر به تغییر شدید آن می شود. تغییرات قابل توجهی در دفع ترکیبات نیتروژن دار در ادرار، عمدتاً در دفع اوره، در صورت عدم وجود آسیب شناسی در صورت تغییر قابل توجه در رژیم غذایی (به عنوان مثال، زمانی که مقدار پروتئین مصرفی تغییر می کند، قابل مشاهده است. و غلظت نیتروژن باقیمانده (نگاه کنید به. نیتروژن باقیمانده ) در خون کمی تغییر می کند.
در یک تحقیق و. لازم است ترکیب کمی و کیفی غذای گرفته شده، ترکیب کمی و کیفی ترکیبات نیتروژنی دفع شده در ادرار و مدفوع و موجود در خون در نظر گرفته شود. برای تحقیق A. در مورد. از مواد نیتروژن دار که با رادیونوکلئیدهای نیتروژن، فسفر، کربن، گوگرد، هیدروژن، اکسیژن برچسب گذاری شده اند استفاده کنید و مهاجرت برچسب و ادغام آن در ترکیب محصولات نهایی A.o را مشاهده کنید. اسیدهای آمینه نشاندار به طور گسترده استفاده می شود، به عنوان مثال، 15 N-گلیسین، که با غذا یا مستقیماً به خون وارد بدن می شود. بخش قابل توجهی از نیتروژن گلیسین مواد غذایی نشاندار شده به صورت اوره همراه با ادرار دفع میشود و قسمت دیگر برچسب وارد پروتئینهای بافتی شده و به آرامی از بدن دفع میشود. انجام تحقیق A. o. برای تشخیص بسیاری از شرایط پاتولوژیک و نظارت بر اثربخشی درمان، و همچنین توسعه رژیم های غذایی منطقی، از جمله ضروری است. دارویی (نگاه کنید به تغذیه پزشکی ).
پاتولوژی A. o. (تا بسیار قابل توجه) باعث کمبود پروتئین می شود. این می تواند ناشی از سوء تغذیه عمومی، کمبود طولانی مدت پروتئین یا اسیدهای آمینه ضروری در رژیم غذایی، کمبود کربوهیدرات ها و چربی هایی باشد که انرژی را برای فرآیندهای بیوسنتز پروتئین در بدن فراهم می کند. کمبود پروتئین ممکن است به دلیل غلبه فرآیندهای تجزیه پروتئین بر سنتز آنها باشد، نه تنها در نتیجه کمبود غذایی پروتئین و سایر مواد مغذی ضروری، بلکه در هنگام کار سنگین عضلانی، صدمات، التهاب و فرآیندهای دیستروفیکایسکمی، عفونت، سوختگی گسترده، نقص در عملکرد تغذیه ای سیستم عصبی، کمبود هورمون های آنابولیک (هورمون رشد، هورمون های جنسی، انسولین)، سنتز بیش از حد یا دریافت بیش از حد هورمون های استروئیدی از خارج و غیره. نقض جذب پروتئین در آسیب شناسی دستگاه گوارش(تخلیه سریع غذا از معده، شرایط کم اسیدی و اسیدی، انسداد مجرای پانکراس، تضعیف عملکرد ترشحی و افزایش تحرک روده کوچک در انتریت و انتروکولیت، اختلال در جذب در روده کوچک و غیره) نیز می تواند باشد. منجر به کمبود پروتئین شود. کمبود پروتئین منجر به ناهماهنگی A. o. و با تعادل منفی نیتروژن مشخص مشخص می شود.
موارد نقض سنتز پروتئین های خاص شناخته شده است (نگاه کنید به. آسیب شناسی ایمنی, فرمنتوپاتی ها), و همچنین سنتز ژنتیکی تعیین شده پروتئین های غیر طبیعی، به عنوان مثال، با هموگلوبینوپاتی ها, مولتیپل میلوما (نگاه کنید به هموبلاستوزهای پاراپروتئینمیک ) و غیره.
آسیب شناسی دریاچه A.، که شامل نقض متابولیسم اسیدهای آمینه است، اغلب با ناهنجاری در فرآیند ترانس آمیناسیون همراه است: کاهش فعالیت آمینوترانسفرازها در طول هیپو یا ویتامین B6، نقض سنتز. از این آنزیم ها، کمبود اسیدهای کتو برای ترانس آمیناسیون به دلیل مهار چرخه اسید تری کربوکسیلیک در طول هیپوکسی و دیابتو غیره. کاهش شدت ترانس آمیناسیون منجر به مهار دآمیناسیون اسید گلوتامیک می شود و این به نوبه خود باعث افزایش نسبت نیتروژن اسید آمینه در ترکیب نیتروژن باقیمانده خون (هیپرآمینواسیدمی)، هیپرازوتمی عمومی و آمینواسیدوری می شود. هیپرآمینواسیدمی، آمینواسیدوری و آزوتمی عمومی مشخصه بسیاری از انواع پاتولوژی A. هستند. با آسیب گسترده کبدی و سایر شرایط مرتبط با تجزیه گسترده پروتئین در بدن، فرآیندهای دآمیناسیون اسیدهای آمینه و تشکیل اوره مختل می شود به گونه ای که غلظت نیتروژن باقی مانده و محتوای نیتروژن اسید آمینه در آن افزایش می یابد. در برابر پس زمینه کاهش محتوای نسبی نیتروژن اوره در نیتروژن باقیمانده (به اصطلاح آزوتمی تولیدی).
آزوتمی تولیدی معمولاً با دفع اسیدهای آمینه اضافی از طریق ادرار همراه است، زیرا حتی در مورد عملکرد طبیعیفیلتراسیون کلیه اسیدهای آمینه در گلومرول ها شدیدتر از بازجذب آنها در لوله ها است. بیماری کلیه، انسداد مجاری ادراری، اختلال در گردش خون کلیوی منجر به ایجاد آزوتمی احتباسی می شود که با افزایش غلظت نیتروژن باقی مانده در خون به دلیل افزایش محتوای اوره در خون همراه است (نگاه کنید به. نارسایی کلیه ). زخم های گسترده، سوختگی های شدید، عفونت ها، آسیب به استخوان های لوله ای، نخاع و مغز، کم کاری تیروئید، بیماری Itsenko-Cushing و بسیاری دیگر بیماری های جدیهمراه با آمینواسیدوری همچنین مشخصه شرایط پاتولوژیک است که با فرآیندهای بازجذب مختل در لوله های کلیوی رخ می دهد: بیماری ویلسون-کونوالوف (نگاه کنید به. دیستروفی کبدی مغزی ), نفرونوفزیس فانکونی (نگاه کنید به. بیماری های شبیه راشیتیسم این بیماریها از جمله اختلالات ژنتیکی متعدد A.o هستند. نقض انتخابی بازجذب سیستین و سیستینوری با اختلال عمومی متابولیسم سیستین در پس زمینه آمینواسیدوری عمومی به اصطلاح سیستینوزیس را همراهی می کند. در این بیماری کریستال های سیستین در سلول های سیستم رتیکولواندوتلیال رسوب می کنند. بیماری ارثی فنیل کتونوری با نقض تبدیل فنیل آلانین به تیروزین در نتیجه کمبود ژنتیکی آنزیم فنیل آلانین - 4-هیدروکسیلاز مشخص می شود که باعث تجمع فنیل آلانین تبدیل نشده و محصولات متابولیک آن - فنیل پیروویک و فنیل استیک در خون و ادرار می شود. نقض دگرگونی های این ترکیبات نیز مشخصه هپاتیت ویروسی است.
تیروزینمی، تیروزینوری و تیروزینوز در لوسمی مشاهده می شود. بیماری های منتشر بافت همبند(کلاژنوزها) و سایر شرایط پاتولوژیک. آنها در نتیجه اختلال در ترانس آمیناسیون تیروزین ایجاد می شوند. یک ناهنجاری مادرزادی دگرگونی های اکسیداتیو تیروزین زمینه ساز آلکاپتونوری است که در آن یک متابولیت تبدیل نشده از این اسید آمینه، هموژنتیزیک اسید، در ادرار تجمع می یابد. اختلالات متابولیسم رنگدانه در هیپوکورتیسیسم (نگاه کنید به. غدد فوق کلیوی ) با مهار تبدیل تیروزین به ملانین به دلیل مهار آنزیم تیروزیناز همراه هستند (از دست دادن کامل سنتز این رنگدانه برای ناهنجاری مادرزادیرنگدانه - آلبینیسم).
هپاتیت مزمن، دیابت، لوسمی حادلوسمی مزمن میلو و لنفوسیتی، لنفوگرانولوماتوز، روماتیسم و اسکلرودرمی، متابولیسم تریپتوفان مختل شده و متابولیت های آن اسیدهای 3-هیدروکسی کینورنین، گزانتورنیک و 3-هیدروکسی ترانیلیک اسید که خاصیت سمی دارند در خون تجمع می یابند. به آسیب شناسی A. در مورد. همچنین شامل شرایط مرتبط با نقض دفع کراتینین توسط کلیه ها و تجمع آن در خون است. افزایش دفع کراتینین با عملکرد بیش از حد همراه است غده تیروئیدو کاهش دفع کراتینین با افزایش دفع کراتین کم کاری تیروئید است.
با یک فروپاشی عظیم ساختارهای سلولی(گرسنگی، کار سنگین عضلانی، عفونت ها و غیره) به افزایش پاتولوژیک غلظت نیتروژن باقیمانده به دلیل افزایش محتوای نسبی نیتروژن اسید اوریک در آن توجه کنید (به طور معمول، غلظت اسید اوریک در خون از آن تجاوز نمی کند. - 0.4 mmol/l).
در سنین بالا، شدت و حجم سنتز پروتئین به دلیل مهار مستقیم عملکرد بیوسنتزی بدن و تضعیف توانایی آن در جذب اسیدهای آمینه غذایی کاهش می یابد. تعادل منفی نیتروژن ایجاد می شود. اختلال در متابولیسم پورین ها در افراد مسن منجر به تجمع و رسوب نمک های اسید اوریک - اورات ها در عضلات، مفاصل و غضروف ها می شود. اصلاح اختلالات و. در سنین بالا می توان از طریق رژیم های غذایی ویژه حاوی پروتئین های حیوانی با درجه بالا، ویتامین ها و عناصر کمیاب با محتوای محدود پورین انجام داد.
متابولیسم نیتروژن در کودکان با تعدادی از ویژگی ها، به ویژه، تعادل مثبت نیتروژن به عنوان متمایز می شود شرط لازمرشد شدت فرآیندهای A. o. در طول رشد کودک دچار تغییراتی می شود، به ویژه در نوزادان و کودکان خردسال. در طول 3 روز اول زندگی، تعادل نیتروژن منفی است، که با دریافت ناکافی پروتئین از غذا توضیح داده می شود. در این دوره، افزایش گذرا در غلظت نیتروژن باقی مانده در خون (به اصطلاح آزوتمی فیزیولوژیکی) تشخیص داده می شود که گاهی به 70 می رسد. mmol/l; تا پایان هفته دوم
در طول زندگی، غلظت نیتروژن باقیمانده به سطح ذکر شده در بزرگسالان کاهش می یابد. مقدار نیتروژن دفع شده توسط کلیه ها در طول 3 روز اول زندگی افزایش می یابد و پس از آن کاهش می یابد و دوباره از هفته دوم شروع به افزایش می کند. زندگی به موازات افزایش مقدار غذا
بیشترین قابلیت هضم نیتروژن در بدن کودک در کودکان در ماه های اول زندگی مشاهده می شود. تعادل نیتروژن به طور قابل توجهی در 3-6 ماه اول به تعادل نزدیک می شود. زندگی، اگرچه مثبت باقی می ماند. شدت متابولیسم پروتئین در کودکان بسیار بالا است - در کودکان سال اول زندگی، حدود 0.9 جیپروتئین برای 1 کیلوگرموزن بدن در روز، در 1-3 سال - 0.8 گرم/کیلوگرم/روزها، در کودکان پیش دبستانی و سن مدرسه - 0,7 گرم/کیلوگرم/روز
مقدار متوسط نیاز به اسیدهای آمینه ضروری، طبق گفته سازمان جهانی بهداشت فائو (1985)، در کودکان 6 برابر بیشتر از بزرگسالان است (یک آمینو اسید ضروری برای کودکان زیر 3 ماه سیستین و تا 5 سال - و هیستیدین). به طور فعال تر از بزرگسالان، فرآیندهای ترانس آمینو اسیدها در کودکان ادامه می یابد. با این حال، در روزهای اول زندگی در نوزادان، به دلیل فعالیت نسبتاً کم آنزیم های خاص، هیپرآمینواسیدمی و آمینواسیدوری فیزیولوژیکی در نتیجه عدم بلوغ عملکردی کلیه ها مشاهده می شود. علاوه بر این، در نوزادان نارس، آمینواسیدوری از نوع اضافه بار، tk وجود دارد. محتوای اسیدهای آمینه آزاد در پلاسمای خون آنها بیشتر از کودکان ترم است. در هفته اول زندگی، نیتروژن اسید آمینه 3-4٪ از کل نیتروژن ادرار را تشکیل می دهد (بر اساس برخی منابع، تا 10٪) و تنها در پایان سال اول زندگی، محتوای نسبی آن کاهش می یابد. 1 درصد در کودکان سال اول زندگی، دفع اسیدهای آمینه در هر 1 کیلوگرموزن بدن به مقادیر دفع آنها در بزرگسالان می رسد، دفع اسید آمینه نیتروژن، در نوزادان به 10 می رسد. میلی گرم بر کیلوگرموزن بدن در سال دوم زندگی به ندرت از 2 تجاوز می کند میلی گرم بر کیلوگرموزن بدن. در ادرار نوزادان، محتوای تورین، ترئونین، سرین، گلیسین، آلانین، سیستین، لوسین، تیروزین، فنیل آلانین و لیزین (در مقایسه با ادرار بزرگسالان) افزایش می یابد. در ماه های اول زندگی، اتانول آمین و هوموسیترولین نیز در ادرار کودک یافت می شود. در ادرار کودکان سال اول زندگی، اسیدهای آمینه پرولین و [هیدرو] اکسی پرولین غالب است.
مطالعات مهم ترین اجزای نیتروژنی ادرار در کودکان نشان داده است که نسبت اسید اوریک، اوره و آمونیاک در طول رشد به طور قابل توجهی تغییر می کند. بله برای 3 ماه اول. زندگی با کمترین مقدار اوره در ادرار (2-3 برابر کمتر از بزرگسالان) و بالاترین دفع اسید اوریک مشخص می شود. کودکان در سه ماه اول زندگی 28.3 دفع می کنند میلی گرم بر کیلوگرموزن بدن اسید اوریک، و بزرگسالان - 8.7 میلی گرم بر کیلوگرم. دفع نسبتاً زیاد اسید اوریک در کودکان در ماه های اول زندگی گاهی به ایجاد انفارکتوس اسید اوریک در کلیه ها کمک می کند. میزان اوره در ادرار در کودکان 3 تا 6 ماهه افزایش می یابد و محتوای اسید اوریک در این زمان کاهش می یابد. محتوای آمونیاک در ادرار کودکان در روزهای اول زندگی کم است، اما پس از آن به شدت افزایش می یابد و در کل سال اول زندگی در سطح بالایی باقی می ماند.
ویژگی مشخصه A. o. در کودکان کراتینوری فیزیولوژیکی است. کراتین در مایع آمنیوتیک یافت می شود. در ادرار، در مقادیر بیش از محتوای کراتین در ادرار بزرگسالان، از دوره نوزادی تا دوره بلوغ تعیین می شود. دفع روزانه کراتینین (کراتین دهیدروکسیله) با افزایش سن افزایش می یابد، در حالی که همزمان با افزایش وزن بدن کودک، محتوای نسبی نیتروژن کراتینین ادرار کاهش می یابد. مقدار کراتینین دفع شده از ادرار در روز در نوزادان ترم 10-13 است. میلی گرم بر کیلوگرمدر نوزادان نارس 3 میلی گرم بر کیلوگرم، در بزرگسالان از 30 تجاوز نمی کند میلی گرم بر کیلوگرم
در هنگام شناسایی در خانواده ای با اختلالات ذاتی و. نیاز
سوال کوتاه
جداسازی محصولات نهایی متابولیسم نیتروژن
اسید اوریک یکی از مهمترین محصولات نهایی متابولیسم نیتروژن در انسان است. به طور معمول، غلظت آن در سرم خون در مردان 0.27-0.48 mmol-l1، در زنان 0.18-0.38 mmol-l-1 است. میزان دفع ادرار روزانه بین 2.3 تا 4.5 میلی مول (400-750 میلی گرم) است. انسان اسید اوریک را دفع می کند و بسیاری از پستانداران دارای آنزیم اوریکاز هستند که اسید اوریک را به آلانتوئین اکسید می کند. در بدن یک فرد سالم در روز، تشکیل و دفع اسید اوریک بین 500 تا 700 میلی گرم است. بیشتر اسید اوریک (تا 80٪) در نتیجه متابولیسم اسیدهای نوکلئیک درون زا تشکیل می شود، تنها حدود 20٪ با پورین های غذا مرتبط است. کلیه ها روزانه حدود 500 میلی گرم اسید اوریک دفع می کنند که 200 میلی گرم از طریق دستگاه گوارش خارج می شود.
پروتئینوری عملکردی پروتئینوری عملکردی که فرآیندهای وقوع دقیق آن مشخص نشده است، شامل موارد مربوط به وضعیت عمودی بدن، غیر دائمی ایدیوپاتیک، دفع پروتئین در ادرار سویه، ظاهر تب دار پروتئین در ادرار و دفع است. پروتئین در ادرار چاقی
پروتئینوری ارتواستاتیک با ظاهر شدن یک پلی پپتید در ادرار در طی عدم فعالیت طولانی مدت یا قدم زدن مشخص می شود و هنگامی که وضعیت بدن به حالت عمودی تغییر می کند، به سرعت ناپدید می شود. ظاهر پروتئین در ادرار در بیشتر موارد از یک گرم در روز تجاوز نمی کند، گلومرولی و غیر انتخابی است، روش ظاهر آن نامشخص است. بیشتر اوقات در نوجوانی مشاهده می شود، در نیمی از بیماران پس از مدتی درمان می شود. مکانیسم تشکیل احتمالاً با افزایش غیر طبیعی پاسخ گردش خون کلیوی به تغییر در محل تنه مرتبط است.
تعریف پروتئینوری ارتواستاتیک با ترکیب شرایط زیر تنظیم می شود:
سن بیماران 13-20 سال؛
نوع بسته پروتئین در ادرار، عدم وجود سایر علائم آسیب کلیه (تغییر ساختار رسوب ادرار، افزایش فشاری که خون در شریان بر دیواره آن وارد می کند، تغییر در عروق سطح داخلی). مردمک چشم);
فقط یک دوره ارتواستاتیک ظاهر پروتئین در ادرار، زمانی که در مطالعات ادرار گرفته شده پس از قرار گرفتن فرد در وضعیت خوابیده به پشت (از جمله صبح روز بعد قبل از بلند شدن از رختخواب)، هیچ پروتئینی وجود ندارد.
برای اثبات این تشخیص، باید آزمایش عمودی انجام شود. برای انجام این کار، ادرار صبح قبل از بلند شدن از رختخواب جمع آوری می شود، سپس پس از مدتی در وضعیت عمودی (حرکت با یک چوب در پشت کمر برای استقرار ستون فقرات). هنگامی که قسمت صبح (شب) ادرار با هم ترکیب می شود (از آنجایی که ادرار باقیمانده در وزیکا ادراری امکان پذیر است)، و قسمت اولیه پس از حضور کوتاه بیمار در وضعیت خوابیده به پشت انتخاب می شود، تشخیص حتی نتایج دقیق تری می دهد.
در سنین پایین، به نوبه خود، ظاهر متناوب اولیه پروتئین در ادرار امکان پذیر است که در افراد سالم در طی معاینه پزشکی ایجاد می شود و در طی آزمایشات ادرار زیر ناپدید می شود.
پروتئینوری تنشی در بیست درصد افراد سالم (حتی ورزشکاران) پس از یک تمرین قوی تشخیص داده می شود. فعالیت بدنی. پروتئین در قسمت آماده شده اولیه ادرار شناسایی می شود. دفع پروتئین در ادرار در طبیعت مرتبط با آسیب شناسی لوله ها. فرض بر این است که الگوریتم ظاهر پروتئین در ادرار با نوترکیبی جریان خون و ایسکمی نسبی قسمت های پروگزیمال نفرون ترکیب شده است.
تب پروتئین در ادرار در شرایط گرم شدید، به ویژه در کودکان و افراد مسن رخ می دهد. دفع تب دار پروتئین در ادرار یک دوره غالباً گلومرولی دارد. فرآیندهای این نوع پروتئینوری کمی مورد مطالعه قرار گرفته است، احتمال افزایش اهمیت آن وجود دارد فیلتراسیون گلومرولیهمراه با شکست کوتاه مدت فیلتر گلومرولی توسط مجتمع های محافظ.
جداسازی پروتئین در ادرار در اضافه وزن پاتولوژیک. دفع پروتئین در ادرار اغلب با رسوب غیر طبیعی چربی در بدن مشاهده می شود. (وزن بدن بیش از 115 کیلوگرم). به گفته J.P.Domfeld (1989)، در میان هزار بیمار با رسوب پاتولوژیک چربی در بدن. 420 نفر با دفع پروتئین در ادرار بدون تخریب لجن ادرار تشخیص داده شدند. سابقه یک سندرم نفروتیک نیز نشان داده شده است. فرض بر این است که علت اصلی تشکیل چنین پروتئینوری، اعوجاج گردش خون در تجمع مویرگ های بسیار دمیده شده است (افزایش فشار در گروه مویرگ های کلیوی، افزایش سرعتفیلتراسیون) همراه با افزایش اضافه وزن پاتولوژیک. غلظت هورمون پلی پپتیدی تولید شده توسط کلیه به دلیل کاهش در فشار خونو هیپرتانسین که در طول روزه داری کاهش می یابد. با کاهش وزن، و همچنین در طول درمان با مهارکننده های ACE، دفع پروتئین ادرار ممکن است کاهش یابد و همچنین از بین برود.
علاوه بر این، پروتئینوری ممکن است شروع خارج کلیوی داشته باشد. در صورت وجود لکوسیت ها در آزمایش ادرار و به خصوص ظاهر شدن خون در ادرار، واکنش تایید کننده به پلی پپتید ممکن است نتیجه تجزیه سلول های خونی در طول ایستادن طولانی مدت ادرار باشد، در این شرایط، ظاهر پروتئین در ادرار ادرار بیش از 0.3 گرم در روز غیر طبیعی به نظر می رسد. آزمایشهای پلی پپتیدی رسوبی میتوانند نتایج مثبت کاذب را در حضور مواد حاجب حاوی ید در ادرار، تعداد قابلتوجهی از داروهای مشابه پنی سیلینوم، و همچنین یک ماده دارویی از گروه آنتیبیوتیکهای نیمه مصنوعی بتالاکتام، محصولات متابولیکی نشان دهند. آماده سازی سولفانیلامید.
اطلاعات مشابه
"نیتروژن باقیمانده" روش کجلدال: در سرم
خون با کل تعیین شد
مقدار نیتروژن و محتوای پروتئین محاسبه شد (در
پروتئین ~ 16 درصد نیتروژن).
بعد از
گواهی
سنجاب
واکنش با TCA در سرم
نیتروژن در آن باقی ماند
ترکیب با وزن مولکولی کم
– باقیمانده (غیر پروتئینی)
نیتروژن" (~0.5٪ از کل نیتروژن،
حدود 0.4 گرم در لیتر).
نیتروژن اوره
50 %
اسیدهای آمینه نیتروژن
تا 25%
اسید اوریک
4%
کراتین و کراتینین
5-7 %
نشان می دهد
0,5 %
آمونیاک
<2%
پپتیدها، نوکلئوتیدها،
بیلی روبین و غیره
~13 %
محصولات نهایی متابولیسم نیتروژن
سنجاب هاAMC
آمین ها
اسیدهای نوکلئیک
پیریمیدین ها
آمونیاک
کراتین
پورین ها
ادراری
به تا
کراتینین
سم زدایی موقت
آمیدهای آمینو اسیدها
با ادرار
اوره
آمونیاک و راه های خنثی سازی آن
دآمیناسیونآمینو اسید
دآمیناسیون
آمین های بیوژنیک
فروپاشی بازهای پیریمیدین NK
NH3
سنتز AK،
پیریمیدین ها،
قندهای آمینه…
آمیدهای دی کربوکسیلیک
اسیدهای آمینه (hln، asn)
تحصیلات
و دفع
آمونیوم
نمک ها
~ 0.5 گرم در روز
سنتز
اوره
25-30 گرم در روز
تشکیل آمیدهای اسیدهای آمینه دی کربوکسیلیک
خنثی سازی موقت NH3 برای انتقال به داخلمقامات، جایی که دفع نهایی آن و
دفع
در تمام اندام ها و بافت ها وجود دارد.
دفع آمونیاک در کلیه ها
NH3 در ادرار به پروتون ها متصل شده و یک کاتیون تشکیل می دهدآمونیوم:
NH3 + H+ ↔ NH4+
NH4+ باعث دفع یون های H+ (یعنی اسیدها) می شود.
حذف نمک های آمونیوم (فسفات ها، استات ها و …)
از دست دادن Na و سایر کاتیون ها را کاهش می دهد.
سنتز اوره
NH3سنتز اوره
ATP
CO2
NH3
کاربامویل فسفات
سیترولین
آسپارتات
اسید سوکسینیک آرژنین
اورنیتین
اگزالواستات
مالات
آرژینین
NH2
با
NH2
در باره
اوره
ATP
فومارات
اوره خون
سرعتتحصیلات
در کبد
اوره
خون
سرعت
حذف
کلیه ها
محدودیت های مرجع - 2.2 - 8.3 mmol / l. نوسانات روزانه
سطح اوره خون به 50% می رسد (حداکثر در عصر).
توانایی سنتز اوره حفظ می شود
آسیب به 85 درصد از بافت کبد. سنتز
اوره
فقط در آسیب بسیار شدید کبدی شکسته می شود
(نکروز حاد، کمای کبدی، سیروز، مسمومیت
فسفر و آرسنیک): سپس در سرم خون
آمونیاک جمع می شود و سطح اوره کاهش می یابد.
تعیین اوره
افزایش سطح اوره خون:نسبی (کم آبی) + مطلق (ازوتمی).
آزوتمی
تولید
حفظ
بزرگ شده است
تحصیلات
کاهش
دفع در ادرار
کلیوی
EXTRARENAL
مرتبط با آسیب شناسی
کلیه
مرتبط با عوامل خارج کلیوی
آزوتمی تولیدی
1.2.
رژیم غذایی غنی از پروتئین
افزایش کاتابولیسم پروتئین - با کاشکسی، لوسمی،
زخم های گسترده، عفونت ها و
التهابی
بیماری هایی با تب بالا، بدخیم
تومورها
رفتار
گلوکوکورتیکوئیدها،
متمرکز
کار عضلانی، هر واکنش فاز حاد...
آزوتمی احتباسی
بیماری کلیوی (GFR< 10 мл/мин) - гломерулонефриты,
پیلونفریت، سل کلیوی، آمیلوئیدوز کلیه…
با نارسایی حاد کلیه، افزایش اوره در خون تا 16 میلی مول در لیتر =
اختلال عملکرد کلیه با شدت متوسط، تا 33 میلی مول در لیتر -
شدید، بیش از 50 میلی مول در لیتر - بسیار شدید (مضر
پیش بینی).
افزایش سطح اوره نشانه اولیه اختلال در عملکرد نیست
کلیه ها.
آزوتمی احتباسی
آزوتمی های احتباس خارج کلیویهمودینامیک و کاهش GFR:
-
در
تخلفات
جبران خسارت قلبی عروقی،
کم آبی بدن (استفراغ غیرقابل کنترل، انسداد
روده، تنگی پیلور، اسهال شدید، خونریزی،
می سوزد...)
شوک تروماتیک، دیابت، بیماری آدیسون و …
آزوتمی معمولاً پایین است (سطح اوره< 13 ммоль/л).
کاهش غلظت اوره
ارزش تشخیصی ندارد. ممکن است مشاهده شود:با هیپرهیدراتاسیون (در / در معرفی محلول های گلوکز و غیره)
در دوران بارداری (اغلب کمتر از 3.33 میلی مول در لیتر).
با افزایش دیورز (ادرار آور).
با گرسنگی و کاهش کاتابولیسم پروتئین.
با آسیب عضلانی (میوزیت، میوپاتی).
روشهای تعیین اوره
رنگ سنجی، اوره آز (فنل-هیپوکلریت، سالیسیلات-هیپوکلریت، گلوتامات دهیدروژناز).
ماده مورد مطالعه سرم یا پلاسمای خون است.
سطح اوره تا 24 ساعت در دمای اتاق پایدار است.
چندین روز در دمای 4-6 درجه سانتیگراد و تا 2-3 ماه در حالت یخ زدگی.
دخالت
غلظت اوره سرم در طول روزه داری کاهش می یابد،رژیم غذایی کم کالری، سیگار کشیدن، نوشیدن مقادیر زیاد
اب…
غلظت اوره با افزایش سن کمی افزایش می یابد. در مردان
تا حدودی بالاتر از زنان است.
در دوران بارداری، غلظت اوره در دوران یائسگی کاهش می یابد
- افزایش.
رژیم غذایی با پروتئین بالا، ورزش
باعث افزایش غلظت اوره در سرم خون می شود.
تخمین بیش از حد نتایج: استون، بیلی روبین، همولیز، لیپمی،
اگزالات (مخلوط یون آمونیوم)، اسید اوریک
+ داروهای نفروتوکسیک، حشره کش.
گزارش کم: اسیدوز (روش دی استیل مونوکسیم).
کراتین و کراتینین
کراتین یک عنصر مهم استمتابولیسم نیتروژن در بدن
کراتین فسفات
گرفتار
V
تأمین انرژی
برش می دهد
ماهیچه،
فعال
حمل و نقل
یون های موجود در بافت عصبی و غیره
سنتز کراتین
کراتین در کلیه ها و پانکراس سنتز می شودآرژنین، گلیسین و متیونین و سپس وارد جریان خون می شود
در عضلات اسکلتی و قلبی، مغز، بافت عصبی.
محتوای کراتین در اندام ها
کلیه ها، کبد،
LJ
مغز
عضلات صاف
عضله قلب
ماهیچه های اسکلتی
0
100
200
300
400
500
600
mg/100
مقدار کمی کراتین (0.05-0.25 گرم در روز) را می توان با
ادرار طبیعی است، خیلی بیشتر - در کودکان و آسیب شناسی.
کراتین، کراتین فسفات و کراتینین
کراتین فسفات - macroerg، تجمع کننده و حاملانرژی در سلول
کراتین کیناز
کراتین
+ ATP
~2%
انرژی
pH
H 2O
کراتین~
فسفات
+ ADP
کراتینین
کراتینین محصول نهایی متابولیسم ("بن بست متابولیک") است.از طریق کلیه ها از طریق ادرار دفع می شود.
سطح کراتینین پلاسما ارتباط مستقیمی با
توده عضلانی زیرا مقادیر مرجع کراتینین در خون است
بستگی به سن و جنس دارد
گروه های سنی
خون از بند ناف
توسط یافا
آنزیمی
53-106 میکرومول در لیتر
نوزادان 1-4 روزه
27-88
کودکان زیر 1 سال
18-35
4-29
فرزندان
27-62
2-5 سال 4-40
6-9 سال 18-46
نوجوانان
44-88
19-52
بزرگسالان 18-60 سال
m 80-115، w 53-97
بزرگسالان 60-90 ساله
m 71-115، w 53-106
بزرگسالان > 90 سال
m 88-150، w 53-115
m 55-96، w 40-66
روش های مطالعه کراتینین
روش سینتیک 2 نقطه ای با واکنش با اسید پیکریک(روش جافه).
کراتینین + پیکرات (pH=12.0) ---> محصول پرتقال
نمونه مورد نیاز: سرم یا هپارین پلاسما (فلوراید و
هپارینات آمونیوم نامناسب است). هنگام نگهداری در یخچال پایدار است
در طول روز، برای نگهداری طولانی مدت - فریز کنید.
آماده سازی بیمار
تنش عضلانی را از بین ببرید، ورزش کنید.
رژیم غذایی نباید حاوی مقدار زیادی گوشت باشد.
اجتناب از الکل، دوزهای زیاد اسید اسکوربیک،
در صورت امکان - داروهای نفروتوکسیک.
آنالیز باید قبل از معاینات رادیوپاک انجام شود.
دخالت
بیولوژیکی: افزایش - داروهای نفروتوکسیک.تحلیلی: افزایش - اسید استواستیک، استون،
اسید اسکوربیک، سفالوسپورین، فلوسیتوزین، لیدوکائین،
ایبوپروفن، لوودوپا، متیل دوپا، نیتروفوران ها، پیروات، ادراری
اسید.
افزایش کاذب - گلوکز، فروکتوز، اجسام کتونیهیستیدین، آسپاراژین، اوره، اسید اوریک، ایندول.
کاهش - n-استیل سیستئین، بیلی روبین، دی پیرون، هموگلوبین،
لیپمی
نوسانات شاخص در طول روز می تواند به 100٪ برسد
(حداکثر - در عصر).
ارزش بالینی و تشخیصی
افزایش غلظت کراتینین:افزایش تحصیلات/ پذیرش
آکرومگالی و غول پیکری (توده عضلانی بزرگ).
مصرف زیاد غذای گوشتی.
انتخاب کاهش یافته است
نارسایی کلیه (حاد و مزمن، هر علتی)
- نقض پرفیوژن، بیماری کلیوی، انسداد مجاری ادراری).
عوامل نفروتوکسیک - ترکیبات جیوه، سولفونامیدها،
تیازیدها، آمینوگلیکوزیدها، تتراسایکلین ها، باربیتورات ها، سالیسیلات ها،
آندروژن …
آسیب های عظیم مکانیکی، عملیاتی و دیگر
عضلات، سندرم له شدن طولانی مدت.
بیماری تشعشع، پرکاری تیروئید
ارزش بالینی و تشخیصی
کاهش غلظت کراتینینگرسنگی.
مصرف گلوکوکورتیکوئیدها
ضعف به دلیل سن یا کاهش عضله
توده ها
بارداری (به خصوص سه ماهه اول و دوم).
کراتینین حساس نیست
بیماری کلیه در مراحل اولیه
هنگام استفاده از روش های آنزیمی باید مراقب بود
برای جلوگیری از تشکیل، سرم را از سلول ها جدا کنید
آمونیوم در نمونه و اغراق در نتایج.
تست ها
1. بیشترین تعدادآمونیاک به عنوان بخشی از جزء نیتروژنی ادرار از بدن دفع می شود:
کراتینین نمک های آمونیوم ایندیکانا اوره . اسید اوریک. اوروبیلینوژن.
2. در مبادله اسیدهای آمینه متیونین و سرین، به عنوان منابع رادیکال های تک کربنی در فرآیندهای بیوسنتزی، ویتامین ها به عنوان کوآنزیم نقش فعالی دارند:
ویتامین C. ویتامین D. ویتامین B 12. ویتامین K. تیامین. اسید فولیک. ویتامین RR. ریبوفلاوین
3. آمینو اسیدهای کتوژنیک عبارتند از:
سرین. والین. لوسین. متیونین. ایزولوسین . هیستیدین لیزین. تیروزین.
4. به دلیل نقض متابولیسم اسیدهای آمینه، بیماری ها ایجاد می شوند:
فروکتوزمی نقرس. آلکاپتونوری. میکسدم. آلبینیسم، فنیل کتونوری. راشیتیسم
5. الیگوفرنی فنیل پیروویک (فنیل کتونوری) منجر به نقض متابولیسم اسید آمینه می شود:
تیروزین لیزین. فنیل آلانین هیستیدین آرژنین.
6. دلیل ایجاد آلکاپتونوری نقض متابولیسم اسید آمینه است:
سیستئین تریپتوفان تیروزین متیونین. هیستیدین آرژنین.
7. اصطلاح "اسیدهای آمینه گلیکوژنیک" به این معنی است:
آستانه کلیوی برای گلوکز را کاهش داده و باعث گلوکوزوری می شود. آنها توانایی سلول ها برای جذب گلوکز را مختل می کنند. قادر به تبدیل به گلوکز و گلیکوژن است. از نظر انرژی می توانند جایگزین گلوکز شوند. می تواند روند گلوکونئوژنز را مهار کند.
8. آمونیاک با وارد شدن به سنتز اوره در کبد در کبد خنثی می شود، موادی که مستقیماً درگیر هستند:
دی اکسید کربن . لیزین. Ornithine.ATP. اسید گلوتامیک. آسپارتات. آمونیاک. اسید اگزالواستیک.
9. در خنثی سازی آمونیاک سمی ممکن است:
اسید استواستیک. سنجاب ها مونوساکاریدها اسید گلوتامیک. اسید آلفا کتوگلوتاریک. اسید لاکتیک.
10. رنگ سیاه ادرار در بیماری مشاهده می شود:
نقرس. فنیل کتونوری. آلکاپتونوری . زردی
11. در مورد آلکاپتونوری، آنزیم معیوب است:
فنیل آلانین مونواکسیژناز دی اکسیژناز (اکسیداز) اسید هموژنتیزیک. فوماریل استواستیک اسید هیدرولاز
12. چه آنزیمی در فنیل کتونوری معیوب است؟
فنیل آلانین مونواکسیژناز. تیروزیناز فوماریا استواستیک اسید هیدرولاز
13. در آلبینیسم، متابولیسم تیروزین مختل می شود:
اکسیداسیون و دکربوکسیلاسیون. ترانس آمیناسیون
14. با تیروزینوز، آنزیم ها معیوب هستند:
فوماریل استواستیک اسید هیدرولاز. تیروزین ترانس آمیناز
15. حداقل نسبت پروتئین کامل در رژیم غذایی کودک از کل دریافتی آنها باید:
50%. 75%. 20%
وظایف موقعیتی
1. مادر جوانی از تیره شدن پوشک ها در حین خشک شدن به پزشک اطلاع داد. در مورد چی بیماری ارثیمی توانی فکر کنی؟ توصیه های غذایی متخصص اطفال چیست؟
2. 27. 36 ساعت پس از تولد، پسر دچار اختلال هوشیاری و تنفس شد. زایمان طبیعی و به موقع است. والدین - پسرعموهاو خواهر. در سرم خون، محتوای آمونیاک بالای 1000 میکرومولار در لیتر (نرمال 80-20)، محتوای اوره 2.5 میلی مول در لیتر (نرمال 2.5-4.5) بود. محتوای اسید اوروتیک در ادرار افزایش می یابد. این کودک 72 ساعت بعد فوت کرد.
به نفع چه چیزی نقائص هنگام تولدمبادله با داده های آزمایشگاهی اثبات شده است؟
3. در کودک 5 ساله پس از هپاتیت عفونیمحتوای اوره در خون 1.9 میلی مول در لیتر بود. چه چیزی را شهادت می دهد این تحلیل? توصیه های پزشک اطفال چیست؟
4. در روزهای اول پس از تولد، یک نوزاد استفراغ، تشنج، افزایش شدید محتوای اسید آمینه اورنیتین در خون مشاهده شد و غلظت اوره بسیار پایین است. کودک چه بیماری دارد؟ از چه توصیه هایی می توان استفاده کرد
5. یک بیمار مبتلا به دیابت قندی دارای مقدار زیادی اوره در خون بود. با این حال، در طول دوره وخامت وضعیت عمومی، غلظت آن در خون به دلایلی کاهش یافت. علل نوسانات سطح اوره در خون را توضیح دهید.
7. کودک 1.5 ماهه دچار بی حالی و بی حالی است. بررسی محتوای فنیل آلانین در خون 35 mg/dl (طبیعی 1.4-1.9 mg/dl)، محتوای فنیل پیرووات در ادرار 150 mg/day (طبیعی 5-8 میلی گرم در روز) را نشان داد. در مورد بیماری، علت آن نتیجه گیری کنید. در این مورد چه توصیه های غذایی لازم است؟
8. یک بیمار 22 ساله مبتلا به سوکسیناتوری آرژنین با موفقیت آمیزی با کتوآنالوگ اسیدهای آمینه فنیل آلانین، والین و لوئین در زمینه رژیم غذایی کم پروتئین درمان شد. غلظت آمونیاک در پلاسما در همان زمان از 90 به 30 میکرومول در لیتر کاهش یافت و دفع سوکسینات آرژنین به طور قابل توجهی کاهش یافت. مکانیسم اثر درمانی کتوآنالوگ اسیدهای آمینه را توضیح دهید.
9. با بیماری ارثی هیپرآمونمی خانوادگی، افزایش مداوم محتوای آمونیاک در خون و عدم وجود کامل سیترولین وجود دارد. اصلی تظاهرات بالینیمرتبط با آسیب CNS چه واکنشی در این بیماری مسدود می شود؟ دفع روزانه اوره چگونه تغییر خواهد کرد؟
10. مقدار قابل توجهی هموژنتیزیک اسید در ادرار بیمار یافت شد. چه نقص آنزیمی ارثی را می توان فرض کرد؟ واکنش مسدود شده در را بنویسید این بیمار. توصیه های غذایی برای این بیمار چیست؟
اختلالات هضم پروتئین در دستگاه گوارش چیست؟ چه آزمایش های اضافی مورد نیاز است؟
11. میزان پروتئین در رژیم غذایی کودکان 3 و 13 ساله توسط پزشک به میزان 2.3 گرم بر کیلوگرم وزن بدن توصیه می شود.
12. کودکی در کلینیک کودکان بستری شده است و نیاز به آنالیز دارد. شیره معده. معرفی پروب دشوار است. چگونه می توان عملکرد ترشحی معده را مطالعه کرد؟
23. پزشک اطفال برای کودک مبتلا به بیماری معده پپسین تجویز کرد. چه دارویی اضافی مورد نیاز است؟ چرا؟
13. با غذا روزانه 80 گرم پروتئین وارد بدن نوجوان می شود. در این مدت 16 گرم نیتروژن از طریق ادرار دفع شد. تعادل نیتروژن در کودک چگونه است؟ او به چه چیزی شهادت می دهد؟
14. با ادرار یک دانش آموز دبیرستانی قوی جسمی،
15 گرم نیتروژن. آیا باید میزان پروتئین رژیم غذایی او را تغییر دهم؟
15. کودک با درد شکم در بخش جراحی بستری شد. معاینه آزمایشگاهی افزایش شدید ایندیکان در ادرار را نشان داد. دلیل احتمالی این تخلف چیست؟
16. مادر کودکی که از اسیدیته پایین شیره معده رنج می برد، به جای اسید کلریدریک که برای او تجویز شده بود، شروع به استفاده از محلول اسید سیتریک کرد.
آیا چنین جایگزینی امکان پذیر است؟ قابل قبول بودن یا عدم پذیرش این جایگزینی را توضیح دهید.
سوالات درس پایانی با موضوع "متابولیسم پروتئین و اسید آمینه"
1. ویژگی های متابولیسم پروتئین ها و اسیدهای آمینه. تعادل نیتروژن فاکتور سایش بدن حداقل پروتئین شاخص ارزش غذاییپروتئین ها رژیم غذایی پروتئین در کودکان خردسال کواشیورکور
2. هضم پروتئین ها پروتئین های دستگاه گوارش و پروآنزیم های آنها. ویژگی سوبسترای پروتئینازها اندو و اگزوپپتیدازها. جذب آمینو اسیدها ویژگی های سنی فرآیندهای هضم و جذب پروتئین ها .
3. پوترفیکاسیون پروتئین ها در روده بزرگ. محصولات پوسیدگی و مکانیسم های خنثی سازی آنها در کبد. ویژگی های روند فرآیندهای پوسیدگی در روده بزرگ نوزادان .
4. وضعیت پویای پروتئین ها در بدن. کاتپسین. اتولیز بافت ها و نقش آسیب لیزوزوم در این فرآیند. منابع و راه های اصلی مصرف آمینو اسیدها دآمیناسیون اکسیداتیو اسیدهای آمینه آمینو اسید اکسیداز، گلوتامات دهیدروژناز. انواع دیگر دآمیناسیون اسیدهای آمینه.
5. ترانس آمیشن. آمینوترانسفرازها و کوآنزیم های آنها اهمیت بیولوژیکی واکنش های ترانس آمیناسیون نقش ویژه ای در این فرآیند، a-ketoglutarate است. دآمیناسیون غیرمستقیم اسیدهای آمینه اهمیت بالینی تعیین فعالیت ترانس آمینازها در سرم خون.
6. دکربوکسیلاسیون اسیدهای آمینه و مشتقات آنها. مهم ترین آمین های بیوژنیک و آنها نقش بیولوژیکی. پوسیدگی آمین های بیوژنیک در بافت ها.
7. محصولات نهایی متابولیسم نیتروژن: نمک های آمونیوم و اوره. منابع اصلی آمونیاک در بدن خنثی سازی آمونیاک بیوسنتز اوره (چرخه اورنیتین). رابطه بین چرخه اورنیتین و چرخه کربس. منشا اتم های نیتروژن اوره. دفع روزانه اوره. نقض سنتز و دفع اوره. هیپرآمونمی ویژگی های سنی دفع نیتروژن محصولات نهایی از بدن کودک زیر 1 سال
8. خنثی سازی آمونیاک در بافت ها: آمیناسیون کاهشی اسیدهای a-keto، آمیداسیون پروتئین، سنتز گلوتامین. نقش ویژه گلوتامین در بدن. گلوتامیناز کلیه تغییر تطبیقی در فعالیت گلوتامیناز کلیه در اسیدوز.
9. ویژگی های متابولیسم فنیل آلانین و تیروزین. استفاده از تیروزین برای سنتز کاتکول آمین ها، تیروکسین و ملانین ها. تجزیه تیروزین به اسیدهای فوماریک و استواستیک. اختلالات ارثیتبادل فنیل آلانین و تیروزین: فنیل کتونوری، آلکاپتونوری، آلبینیسم.
10. ویژگی های متابولیسم سرین، گلیسین، سیستئین، متیونین. ارزش تتراهیدروفولیک اسید و ویتامین B12 در متابولیسم رادیکال های تک کربنی کمبود اسید فولیک و ویتامین B12. مکانیسم اثر باکتریواستاتیک داروهای سولفا.
11. رابطه متابولیسم اسید آمینه با متابولیسم کربوهیدرات و چربی. اسیدهای آمینه گلیکوژنیک و کتوژنیک. آمینو اسیدهای قابل تعویض و غیر قابل تعویض. بیوسنتز اسیدهای آمینه از کربوهیدرات ها.
ساختار و متابولیسم اسیدهای نوکلئیک
1. ترکیب RNA شامل بازهای نیتروژنی است:
آدنین. گوانین. اوراسیل . تیمین سیتوزین.
2. نوکلئوتیدهای منفرد در یک زنجیره پلی نوکلئوتیدی توسط پیوندهایی به هم متصل می شوند:
پپتید. فسفودی استر. دی سولفید. هیدروژن.
3. آنزیم ها در هضم اسیدهای نوکلئیک نقش دارند - قسمت های تشکیل دهنده نوکلئوپروتئین های غذا:
پپسین. ریبونوکلئاز تریپسین فسفولیپازها دئوکسی ریبونوکلئاز آمیلاز. نوکلئوتیداز فسفاتازها
4. اسیدهای نوکلئیک کمترین وزن مولکولی را دارند:
DNA rRNA. tRNA mRNA
5. محصول نهایی تجزیه بازهای نیتروژنی پورین در بدن انسان عبارت است از:
6. ارزش دفع روزانه اسید اوریک از طریق ادرار در یک فرد بالغ سالم است:
0.01-0.05 گرم 0.06-0.15 گرم 0.35-1.5 گرم 2.5-5.0 گرم
7. محصول نهایی تجزیه در بدن انسان بازهای نیتروژنی پیریمیدین عبارت است از:
اوره اسید اوریک. نمک های آمونیوم کراتینین
8. نقض مبادله بازهای نیتروژنی پورین؟ ممکن است رخ دهد شرایط پاتولوژیک:
نقرس. بیماری Basedow. بیماری سنگ کلیه. بیماری لش نیهان. هیپرآمونمی
9. مواد و مصالح ساختمانیدر سنتز ماتریکس اسیدهای نوکلئیک موادی وجود دارند:
مونوفسفات های نوکلئوزیدی دی فسفات های نوکلئوزیدی نوکلئوزید تری فسفات ها نوکلئوتیدهای حلقوی
1. فرآیند بیوسنتز RNA نامیده می شود:
11. بیوسنتز پروتئین، که با مشارکت پلی زوم ها و tRNA انجام می شود، نامیده می شود:
رونویسی. پخش. همانند سازی. تعمیر. نوترکیبی.
12. راه اصلی تولید مثل اطلاعات ژنتیکی نام دارد:
رونویسی. پخش. همانند سازی. تعمیر. نوترکیبی.
13 تبدیل pro-RNA به اشکال "بالغ" نامیده می شود:
نوترکیبی. در حال پردازش. همانند سازی. پخش. خاتمه دادن.
14. پردازش و -RNA، i.e. بلوغ او این است:
حذف اینترون ها حذف اگزون ها اصلاحات خاص (متیلاسیون، دآمیناسیون و غیره).
15 "بی معنی - کدون ها" (کدون های بی معنی) در ساختار mRNA یک سیگنال هستند:
سیگنال شروع سنتز پروتئین کدون جهش یافته. سیگنال برای پایان دادن به سنتز پروتئین. سیگنال برای اتصال گروه های مصنوعی به پروتئین سنتز شده.
16. اصطلاح "دژنراسیون" کد ژنتیکی به این معنی است:
توانایی یک اسید آمینه برای رمزگذاری توسط بیش از یک کدون. توانایی یک کدون برای کد کردن چندین اسید آمینه. محتوای چهار نوکلئوتید در یک کدون. محتوای دو نوکلئوتید در یک کدون.
17. قوانین Chargaff که ویژگی های ساختار مارپیچ دوگانه DNA را مشخص می کند عبارتند از:
A = T. G = C. A = C. G = T. A + G = C + T. A + T = G + C.
17. برای سنتز بازهای پیریمیدین de novo از مواد زیر استفاده می شود:
دی اکسید کربن. گلوتامات. گلوتامین. آسپارتات. آلانین.
19. برای تشکیل چرخه پورین در طول سنتز نوکلئوتیدهای پورین از مواد زیر استفاده می شود:
دی اکسید کربن. آسپارتات. آلانین. گلیکوکول. گلوتامین. مشتقات تتراهیدروفولات
20. اختصاصی بودن برهمکنش اسیدهای آمینه با t-RNA به این دلیل است:
ترکیب آنتی کدون یکی از ویژگی های سازمان ساختاری tRNA. ویژگی aminoacyl-tRNA سنتتاز. ساختار اسید آمینه
21. برای سنتز نوکلئوتیدهای پیریمیدین از موارد زیر استفاده می شود:
CO2. گلوتامین. آسپارتات. آلانین
22. پیش سازهای سنتز نوکلئوتیدهای پورین عبارتند از:
اسید اینوزیک اسید اوروتیک اسید اوریک
23 اوروتااسیدوری زمانی ایجاد می شود که "بلوک" آنزیم:
کاربامویل آسپارتات ترانسفراز فسفریبوزیل ترانسفراز اوروتات
گزانتین اکسیداز
24. اولین مرحله در سنتز حلقه پیریمیدین عبارت است از:
کاربامویل فسفات. ریبوز-5-فسفات. اسید اوروتیک. آسپارتات
25. نوکلئوتید - پیش ساز در سنتز نوکلئوتیدهای پیریمیدین عبارت است از:
اینوزین مونوفسفات اوروتات مونوفسفات. اسید زانتیلیک اسید اوروتیک
26. آنزیم های کلیدی در سنتز نوکلئوتیدهای پیریمیدین عبارتند از:
27. آنزیم های کلیدی در سنتز در سنتز نوکلئوتیدهای پورین عبارتند از:
کاربامویل فسفوسنتاز کاربامویل آسپارتات ترانسفراز فسفریبوزیل آمیدوترانسفراز
28. با نقص ایمنی، فعالیت آنزیم ها کاهش می یابد:
آدنوزین دآمیناز گزانتین اکسیداز پورین نوکلئوزید فسفوریلاز
29. با سندرم لش نیهان، فعالیت آنزیم کاهش می یابد:
گزانتین اکسیداز آدنین فسفریبوزیل ترانسفراز. هیپوگزانتین-گوانین فسفریبوزیل ترانسفراز
30. فعالیت آنزیم در اوروتاتاسیدوری کاهش می یابد:
فسفریبوزیل ترانسفراز اوروتات. دی هیدروروتات دهیدروژناز. کاربامویل آسپارتات ترانسفراز
31. فرآیند تبدیل pro-RNA به اشکال بالغ نامیده می شود:
نوترکیبی. در حال پردازش. پخش. خاتمه دادن. همانند سازی
32. هنگامی که اتصال اتفاق می افتد:
برش کپی از اینترون ها برداشتن کپی از اگزون ها. اتصال مناطق RNA اطلاعاتی
33. برای رونویسی، شما نیاز دارید:
DNA آغازگر. RNA پلیمراز عوامل پروتئینی نوکلئوتید تری فسفات ها توپوایزومراز
34. آنزیم ها در سنتز RNA نقش دارند:
RNA پلیمراز DNA پلیمراز توپوایزومرازها Primases
35. اگزونهای pro-RNA نامیده می شوند:
مناطق غیر کد کننده پروتئین های جانبی سایت ترمینال مناطق کدگذاری شروع سایت
36. آنزیم ها در ترمیم DNA نقش دارند:
لیگازهای DNA DNA پلیمرازها.) آنزیم های محدود کننده DNA. Primases
37. همانند سازی مستلزم:
DNA آغازگر. I-RNA. عوامل پروتئینی نوکلئوتید تری فسفات ها
T opoisomerase
38. آنزیم ها در سنتز DNA نقش دارند:
RNA پلیمراز DNA پلیمراز پپتیدیل ترانسفرازها tتوپوایزومرازها Primases
39. موارد زیر در تنظیم سنتز پروتئین نقش دارند:
ژن تنظیم کننده اگزون. ژن اپراتور سرکوبگر. اینترون. ژن ساختاری
40. با اصلاح پس از ترجمه پروتئین ها، موارد زیر امکان پذیر است:
پروتئولیز جزئی گلیکوزیلاسیون اصلاح اسید آمینه پیوست یک گروه پروتز
41. فرآیند حرکت mRNA در طول ریبوزوم نامیده می شود:
جابجایی. پخش. خاتمه دادن
42. یک آنزیم در تشکیل پیوند پپتیدی در طی بیوسنتز پروتئین ها نقش دارد:
پپتیدیل ترانسفراز توپوایزومراز هلیکاز
43. سیگنال شروع و پایان سنتز یک زنجیره پلی پپتیدی:
کدون های خاصی از mRNA آنزیم های خاص اسیدهای آمینه خاص
44. دفع روزانه اوره در بزرگسالان عبارت است از:
1.0-2.0 گرم 20.0-30.0 گرم 2.0-8.0 گرم 35.0-50.0 گرم 8.0-20.0 گرم
0.1-0.3 میلیمولار در لیتر. 0.17-0.41 میلیمولار در لیتر. 0.05-0.1 میلی مولار در لیتر
46. نسبت نیتروژن اسید اوریک در ادرار کودکان:
1-3%. 3-8,5 %. 0,5-1,0 %.
47. نسبت نیتروژن اوره در ادرار نوزادان:
30% . 75% . 50%.
وظایف موقعیتی
1. بیمار از درد در مفاصل شکایت دارد. محتوای اسید اوریک در خون 0.26 میلی مول در لیتر است. مقدار اسیدهای سیالیک - 4.5 میلی مول در لیتر
(هنجار 2.0-2.6 میلی مول در لیتر). چه بیماری را می توان رد کرد؟
2. یک کودک نقص ژنتیکی در آنزیم هیپوگزانتین-گوانین فسفریبوزیل ترانسفراز دارد. این چه عواقبی می تواند داشته باشد؟
3. بیمار از درد در مفاصل شکایت دارد. محتوای اسید اوریک در خون 0.56 میلی مول در لیتر است. مقدار اسیدهای سیالیک 2.5 میلی مول در لیتر است (هنجار 2.0-2.6 میلی مول در لیتر). چه بیماری بیشتر محتمل است؟ چه رژیمی نشان داده شده است؟
4. در نتیجه یک جهش ژنی، ترتیب تناوب نوکلئوتیدها در کدون تغییر می کند. این به چه چیزی می تواند منجر شود؟
5. در کودک مبتلا به هیپوویتامینوز، تبادل اسیدهای نوکلئیک کاهش می یابد. دلایل تخلف را توضیح دهید. کدام ویتامین ها ابتدا نشان داده می شوند؟
6. در دیابت شیرین، سرعت سنتز اسید نوکلئیک به میزان قابل توجهی کاهش می یابد. علل احتمالی این تخلف را شرح دهید.
7. در نتیجه یک جهش ژنی، ترتیب تناوب نوکلئوتیدها در کدون تغییر می کند. این به چه چیزی می تواند منجر شود؟
8. سلول های تومور با تقسیم سلولی و رشد سریع مشخص می شوند. چگونه می توان با تأثیرگذاری بر سنتز بازهای نیتروژنی از این امر جلوگیری کرد؟
سوالات درس پایانی با موضوع "تبادل نوکلئوپروتئین"
1. اسیدهای نوکلئیک به عنوان ترکیبات پلیمری ترکیب و ساختار نوکلئوتیدها، عملکرد آنها در بدن. اهمیت بیولوژیکی اسیدهای نوکلئیک سطوح سازمان ساختاری. ویژگی گونه ساختار اولیه.
2. انواع اصلی اسیدهای نوکلئیک در بافت ها. خصوصیات کلی آنها ویژگی های خاص ترکیب شیمیاییساختار و خواص مولکول های DNA. مکمل بودن بازهای نیتروژنی دناتوره سازی و بازسازی DNA. هیبریداسیون DNA "DNA و DNA" RNA.
3. پوسیدگی در بافت های پیریمیدین و نوکلئوتید پورین. محصولات نهایی پوسیدگی ویژگی های دفع اسید اوریک از بدن. هیپراوریسمی نقرس.
4. بیوسنتز نوکلئوتیدهای پیریمیدین مکانیسم های تنظیم آلوستریک
5. بیوسنتز نوکلئوتیدهای پورین منشا بخش هایی از هسته پورین. مراحل اولیهبیوسنتز اسید اینوزینیک به عنوان پیش ساز اسیدهای آدنیلیک و گوانیلیک. مکانیسم های آلوستریک تنظیم بیوسنتز.
6. بیوسنتز DNA تکرار و ترمیم آسیب. آنزیم های بیوسنتزی DNA ماتریس. مطابقت ساختار اولیه محصول واکنش با ساختار اولیه ماتریس. بذر (پرایمر). نقش ماتریسی RNA Revertase.
7. بیوسنتز RNA RNA پلیمراز رونویسی انتقال اطلاعات از DNA به RNA است. تشکیل رونوشت اولیه، بلوغ آن (پردازش).
8. بیوسنتز پروتئین ها. ماتریس (اطلاعات) RNA. اصل اساسی زیست شناسی مولکولی: پروتئین DNA®iRNA. مطابقت توالی نوکلئوتیدی ژن با توالی اسید آمینه پروتئین (هم خطی). مشکل ترجمه (ترجمه) یک رکورد نوکلئوتیدی چهار رقمی اطلاعات به یک رکورد اسید آمینه بیست رقمی. ویژگی های کد نوکلئوتیدی
9. RNA حمل و نقل (tRNA)، ویژگی های ساختاری و عملکردی. اشکال ایزوگیرنده tRNA بیوسنتز aminoacyl-tRNA. اهمیت ویژگی بالای سوبسترا سنتتازهای آمینواسیل-tRNA
10. سیستم های بیولوژیکی بیوسنتز پروتئین ساختار ریبوزوم توالی رویدادها در بیوسنتز یک زنجیره پلی پپتیدی. شروع، طویل شدن، خاتمه. تنظیم بیوسنتز پروتئین مهارکننده های بیوسنتز ماتریکس: داروها، سموم ویروسی و باکتریایی. تغییر پس از ترجمه در زنجیره پلی پپتیدی
 متابولیسم نیتروژن - مجموعه ای از دگرگونی های شیمیایی مواد حاوی نیتروژن در بدن. A. o. شامل تبادل پروتئین های ساده و پیچیده، اسیدهای نوکلئیک، محصولات پوسیدگی آنها (پپتیدها، اسیدهای آمینه و نوکلئوتیدها)، مواد چربی مانند حاوی نیتروژن (لیپیدها)، قندهای آمینه، هورمون ها، ویتامین ها و غیره است. فرآیندها، بدن باید تامین شود مقدار لازمنیتروژن قابل هضم اصلی بخشی جدایی ناپذیرو منبع اصلی نیتروژن غذای انسان مواد پروتئینی هستند
متابولیسم نیتروژن - مجموعه ای از دگرگونی های شیمیایی مواد حاوی نیتروژن در بدن. A. o. شامل تبادل پروتئین های ساده و پیچیده، اسیدهای نوکلئیک، محصولات پوسیدگی آنها (پپتیدها، اسیدهای آمینه و نوکلئوتیدها)، مواد چربی مانند حاوی نیتروژن (لیپیدها)، قندهای آمینه، هورمون ها، ویتامین ها و غیره است. فرآیندها، بدن باید تامین شود مقدار لازمنیتروژن قابل هضم اصلی بخشی جدایی ناپذیرو منبع اصلی نیتروژن غذای انسان مواد پروتئینی هستند

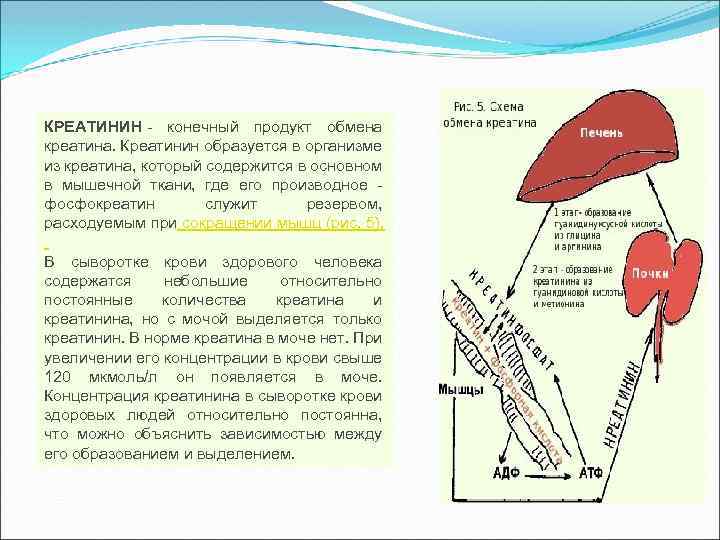 کراتینین محصول نهایی متابولیسم کراتین است. کراتینین در بدن از کراتین تشکیل می شود که عمدتاً در آن یافت می شود بافت ماهیچه ای، که در آن مشتق آن، فسفوکراتین، به عنوان ذخیره مصرف شده در طول انقباض عضلانی عمل می کند (شکل 5). سرم خون یک فرد سالم حاوی مقادیر کم و نسبتاً ثابتی کراتین و کراتینین است، اما فقط کراتینین از طریق ادرار دفع می شود. به طور معمول، کراتین در ادرار وجود ندارد. با افزایش غلظت آن در خون بیش از 120 میکرومول در لیتر، در ادرار ظاهر می شود. غلظت کراتینین سرم افراد سالمنسبتاً ثابت است که می تواند با رابطه بین تشکیل و انتشار آن توضیح داده شود.
کراتینین محصول نهایی متابولیسم کراتین است. کراتینین در بدن از کراتین تشکیل می شود که عمدتاً در آن یافت می شود بافت ماهیچه ای، که در آن مشتق آن، فسفوکراتین، به عنوان ذخیره مصرف شده در طول انقباض عضلانی عمل می کند (شکل 5). سرم خون یک فرد سالم حاوی مقادیر کم و نسبتاً ثابتی کراتین و کراتینین است، اما فقط کراتینین از طریق ادرار دفع می شود. به طور معمول، کراتین در ادرار وجود ندارد. با افزایش غلظت آن در خون بیش از 120 میکرومول در لیتر، در ادرار ظاهر می شود. غلظت کراتینین سرم افراد سالمنسبتاً ثابت است که می تواند با رابطه بین تشکیل و انتشار آن توضیح داده شود.
 اوره محصول نهایی تجزیه پروتئین در بدن است که وقتی از طریق کلیه ها دفع می شود، بقایای نیتروژن "غیر ضروری" را از بین می برد. در کبد تشکیل می شود. همراه با ادرار و قسمتی با عرق (که بوی خاصی به عرق می دهد) دفع می شود. اوره به بدن کمک می کند آب و برخی عناصر کمیاب را حفظ کند. این کار از طریق بازجذب توسط کلیه ها به جریان خون انجام می شود. هر بار که فرآیند جذب اتفاق میافتد، اوره مولکولهای آب را به داخل خون برمیگرداند و مواد معدنی مفید. با این حال، محتوای بیش از حد آن به اندام ها و بافت ها آسیب می رساند.
اوره محصول نهایی تجزیه پروتئین در بدن است که وقتی از طریق کلیه ها دفع می شود، بقایای نیتروژن "غیر ضروری" را از بین می برد. در کبد تشکیل می شود. همراه با ادرار و قسمتی با عرق (که بوی خاصی به عرق می دهد) دفع می شود. اوره به بدن کمک می کند آب و برخی عناصر کمیاب را حفظ کند. این کار از طریق بازجذب توسط کلیه ها به جریان خون انجام می شود. هر بار که فرآیند جذب اتفاق میافتد، اوره مولکولهای آب را به داخل خون برمیگرداند و مواد معدنی مفید. با این حال، محتوای بیش از حد آن به اندام ها و بافت ها آسیب می رساند.
 اسید اوریک محصول نهایی متابولیسم بازهای پورینی که نوکلئوتیدها را تشکیل می دهند. به دلیل دفع اسید اوریک، نیتروژن اضافی از بدن خارج می شود. در پلاسما، اسید اوریک عمدتاً به شکل نمک سدیم یافت می شود. غلظت اسید اوریک در خون به دلیل تعادل فرآیندهای سنتز اسید اوریک و دفع آن توسط کلیه ها است.
اسید اوریک محصول نهایی متابولیسم بازهای پورینی که نوکلئوتیدها را تشکیل می دهند. به دلیل دفع اسید اوریک، نیتروژن اضافی از بدن خارج می شود. در پلاسما، اسید اوریک عمدتاً به شکل نمک سدیم یافت می شود. غلظت اسید اوریک در خون به دلیل تعادل فرآیندهای سنتز اسید اوریک و دفع آن توسط کلیه ها است.
 راه های تشکیل آمونیاک اسید گلوتامیک - کتوگلوتاریک اسید + NH 3 - اسید آمینه - کتواسید + NH 3 سیستئین پیروات + NH 3 هیستیدین اوروکائیک اسید + NH 3 گلیسین گلیوکسالیک اسید + NH 3 گلوکزامین - 6 گلوکوز - فس فسفات + NH 3 گلوتامین گلوتامیک اسید + NH 3 O ║ NH 2 -C O-P + CO 2 + NH 3 کربوموئیل فسفات گلوتامین ATP ADP اوره پیریمیدین ها اسید فولیکپورین گلوکزامین
راه های تشکیل آمونیاک اسید گلوتامیک - کتوگلوتاریک اسید + NH 3 - اسید آمینه - کتواسید + NH 3 سیستئین پیروات + NH 3 هیستیدین اوروکائیک اسید + NH 3 گلیسین گلیوکسالیک اسید + NH 3 گلوکزامین - 6 گلوکوز - فس فسفات + NH 3 گلوتامین گلوتامیک اسید + NH 3 O ║ NH 2 -C O-P + CO 2 + NH 3 کربوموئیل فسفات گلوتامین ATP ADP اوره پیریمیدین ها اسید فولیکپورین گلوکزامین
Src="http://present5.com/presentation/229073585_437016682/image-8.jpg" alt="علل هیپرآمونیمی مسمومیت آمونیاکی (>25 -40 میکرومول در لیتر) نقض عملکرد اوره کبد نقض عملکرد دفع نیتروژن"> ПРИЧИНЫ АММИАЧНОЙ ИНТОКСИКАЦИИ ГИПЕРАММОНИЙЕМИЯ (>25 -40 мкмоль/л) Нарушение мочевинообразующей функции печени Нарушение азотовыделительной функции почек Острая !} نارسایی کلیه هپاتیت ویروسینارسایی مزمن کلیه هپاتیت سمی سیروز کبدی آناستوموز پورتاکاوال در زمینه مواد غذایی غنی از پروتئین هیپرآمونمی مادرزادی
 نیتروژن باقیمانده و اجزای آن شاخص محتوای سرم خون بر حسب میلی گرم/100 میلی لیتر واحد SI نیتروژن باقی مانده 20-40 میلی گرم/100 میلی لیتر 7.06-14.1 میلی مول در لیتر اوره 20-40 میلی گرم در 100 میلی لیتر 3.3-6. 6 میلی مول در لیتر نیتروژن اسیدها 2.0-4.3 mg/100 ml 1.43-3.07 mmol/l اسید اوریک 2-6.4 mg/100 ml 0.12-0.38 mmol/l مردان 0، 2-0.7 mg/100 ml 13-53 میکرومول در لیتر زنان 0.4-0.9 میلی گرم /100 میلی لیتر 27-71 میکرومول در لیتر مردان 1-2 میلی گرم / 100 میلی لیتر 0.088-0.177 میلی مول در لیتر زنان 0.5-1.6 mg/100 ml 0.044-0.141 mmol/l آمونیاک 0.03-0.06 mg/100-ml 21.21. کراتینین: سایر مواد غیر پروتئینی (پلی پپتیدها، نوکلئوتیدها و ...) واکنش زانتوپروتئین 20 واحد. کراتین: خون کامل 3-4 میلی گرم % 229-305 میکرومول در لیتر پلاسما 1- 1.5 میلی گرم % 76.3- 114.5 میکرومول در لیتر نیتروژن اوره خون (اوره: 2، 14) 9-14 میلی گرم % 3، 18- 4.94 میلی مول در لیتر
نیتروژن باقیمانده و اجزای آن شاخص محتوای سرم خون بر حسب میلی گرم/100 میلی لیتر واحد SI نیتروژن باقی مانده 20-40 میلی گرم/100 میلی لیتر 7.06-14.1 میلی مول در لیتر اوره 20-40 میلی گرم در 100 میلی لیتر 3.3-6. 6 میلی مول در لیتر نیتروژن اسیدها 2.0-4.3 mg/100 ml 1.43-3.07 mmol/l اسید اوریک 2-6.4 mg/100 ml 0.12-0.38 mmol/l مردان 0، 2-0.7 mg/100 ml 13-53 میکرومول در لیتر زنان 0.4-0.9 میلی گرم /100 میلی لیتر 27-71 میکرومول در لیتر مردان 1-2 میلی گرم / 100 میلی لیتر 0.088-0.177 میلی مول در لیتر زنان 0.5-1.6 mg/100 ml 0.044-0.141 mmol/l آمونیاک 0.03-0.06 mg/100-ml 21.21. کراتینین: سایر مواد غیر پروتئینی (پلی پپتیدها، نوکلئوتیدها و ...) واکنش زانتوپروتئین 20 واحد. کراتین: خون کامل 3-4 میلی گرم % 229-305 میکرومول در لیتر پلاسما 1- 1.5 میلی گرم % 76.3- 114.5 میکرومول در لیتر نیتروژن اوره خون (اوره: 2، 14) 9-14 میلی گرم % 3، 18- 4.94 میلی مول در لیتر
 تولید هیپرازوتمی نارسایی هپاتوسلولار بخش های غیر اوره از نیتروژن باقیمانده (آمونیوم، نیتروژن آمونیوم، آمین های بیوژنیک)؛ ↓کسری از اوره در نیتروژن باقیمانده کاتابولیسم پروتئین افزایش یافته (گرسنگی، تغذیه بیش از حد) بخش های غیر اوره از نیتروژن باقیمانده (آمونیم، نیتروژن آمونیوم، آمین های بیوژنیک). کسر اوره در احتباس نیتروژن باقیمانده نارسایی حاد و مزمن کلیوی AKI: غلظت اوره پلاسما، ↓ پاکسازی اوره، نیتروژن باقیمانده و نیتروژن اوره CRF: نیتروژن باقیمانده تا 200-300 میلی گرم در 100 میلی لیتر، شما، پپتیدها ("متوسط) در پلاسما
تولید هیپرازوتمی نارسایی هپاتوسلولار بخش های غیر اوره از نیتروژن باقیمانده (آمونیوم، نیتروژن آمونیوم، آمین های بیوژنیک)؛ ↓کسری از اوره در نیتروژن باقیمانده کاتابولیسم پروتئین افزایش یافته (گرسنگی، تغذیه بیش از حد) بخش های غیر اوره از نیتروژن باقیمانده (آمونیم، نیتروژن آمونیوم، آمین های بیوژنیک). کسر اوره در احتباس نیتروژن باقیمانده نارسایی حاد و مزمن کلیوی AKI: غلظت اوره پلاسما، ↓ پاکسازی اوره، نیتروژن باقیمانده و نیتروژن اوره CRF: نیتروژن باقیمانده تا 200-300 میلی گرم در 100 میلی لیتر، شما، پپتیدها ("متوسط) در پلاسما
 منابع و روشهای خنثیسازی آمونیاک در بافتهای مختلف آمینهای بیوژنیک اسیدهای آمینه نوکلئوتیدها آمونیاک سنتز تشکیل اوره گلوتامین آلانین گلوتامات نمکهای آمونیوم (25 گرم در روز) (0.5 گرم در آزمایش مغز، کلیهها در تست مغز در روز)
منابع و روشهای خنثیسازی آمونیاک در بافتهای مختلف آمینهای بیوژنیک اسیدهای آمینه نوکلئوتیدها آمونیاک سنتز تشکیل اوره گلوتامین آلانین گلوتامات نمکهای آمونیوم (25 گرم در روز) (0.5 گرم در آزمایش مغز، کلیهها در تست مغز در روز)
 واکنشهای اتصال آمونیاک در سلول 1. واکنش آمیناسیون احیاکننده -کتوگلوتارات به L-گلوتامات: NADPH 2 NADPH NH 3 + -کتوگلوتاریک گلوتامیک + اسید گلوتامات دهیدروژناز H 2 O 2. واکنش تشکیل اسید گلوتامین از گلوتامین با مشارکت آنزیم گلوتامین سنتتاز. واکنش در سیتوزول سلولهای تمام بافتها، اما به میزان بیشتری در مغز ادامه مییابد: COOH CONH 2 │ │ CH 2 ATP ADP + Fn CH 2 │ CH 2 2 CH │ │ HC-NH 2 گلوتامین سنتز NH 2 │ │ COOH COOH گلوتامین گلوتامین اسید
واکنشهای اتصال آمونیاک در سلول 1. واکنش آمیناسیون احیاکننده -کتوگلوتارات به L-گلوتامات: NADPH 2 NADPH NH 3 + -کتوگلوتاریک گلوتامیک + اسید گلوتامات دهیدروژناز H 2 O 2. واکنش تشکیل اسید گلوتامین از گلوتامین با مشارکت آنزیم گلوتامین سنتتاز. واکنش در سیتوزول سلولهای تمام بافتها، اما به میزان بیشتری در مغز ادامه مییابد: COOH CONH 2 │ │ CH 2 ATP ADP + Fn CH 2 │ CH 2 2 CH │ │ HC-NH 2 گلوتامین سنتز NH 2 │ │ COOH COOH گلوتامین گلوتامین اسید
 مسیرهای تبادل آمینو اسیدهای نیتروژن و آمونیاک بافت خون کبد ماهیچهها، رودهها Amino-KG Ala-KG NH 3 Ketok-you گلوتامات پیرووات گلوتامات CO 2 AMP NH 3 گلوکز کربوموئیل IMF گلوتامات دیگر 3 Ketok-you گلوتامات گلوتامین -KG کلیه NH 3 گلوتامات NH 3 ادرار چرخه اورنیتین NH 3 گلوتامات اوره آمونیوم نمک های گلوتامات اوره
مسیرهای تبادل آمینو اسیدهای نیتروژن و آمونیاک بافت خون کبد ماهیچهها، رودهها Amino-KG Ala-KG NH 3 Ketok-you گلوتامات پیرووات گلوتامات CO 2 AMP NH 3 گلوکز کربوموئیل IMF گلوتامات دیگر 3 Ketok-you گلوتامات گلوتامین -KG کلیه NH 3 گلوتامات NH 3 ادرار چرخه اورنیتین NH 3 گلوتامات اوره آمونیوم نمک های گلوتامات اوره
 چرخه اوره و ارتباط آن با سیتوپلاسم TCA NH 3 + CO 2 + H 2 O L - آسپارتات 2 ATP کربومویل فسفات سیترولین آرژینینوسوکسینات اگزالواستات میتوکندری مالات میتوکندری اورنیتین آرژنین فومارات TCA
چرخه اوره و ارتباط آن با سیتوپلاسم TCA NH 3 + CO 2 + H 2 O L - آسپارتات 2 ATP کربومویل فسفات سیترولین آرژینینوسوکسینات اگزالواستات میتوکندری مالات میتوکندری اورنیتین آرژنین فومارات TCA

