Betaferon: دستورالعمل استفاده و بررسی
نام لاتین:بتافرون
کد ATX: L03AB08
ماده شیمیایی فعال:اینترفرون بتا-1b
سازنده: Boehringer Ingelheim Pharma (آلمان)
به روز رسانی توضیحات و عکس: 06.08.2019
بتافرون یک داروی تعدیل کننده ایمنی است که در درمان مولتیپل اسکلروزیس استفاده می شود.
فرم انتشار و ترکیب
شکل دوز - لیوفیلیزه برای تهیه محلول برای تجویز زیر جلدی: توده سفید لیوفیلیزه (در بطری های شیشه ای کامل با حلال (در سرنگ)، در پالت های پلاستیکی، 5 یا 15 پالت در یک جعبه مقوایی).
در 1 بطری:
- ماده شیمیایی فعال: اینترفرون نوترکیب بتا-1b - 9.6 میلیون واحد بین المللی (0.3 میلی گرم).
- مواد کمکی: آلبومین انسانی، مانیتول.
حلال: محلول کلرید سدیم 0.54% (استریل).
فارماکودینامیک و فارماکوکینتیک
اینترفرون بتا-lb که بخشی از دارو است، دارای فعالیت تعدیل کننده ایمنی و ضد ویروسی است.
مکانیسم اثر این ماده در مولتیپل اسکلروزیس به طور کامل مشخص نشده است، اما مشخص شده است که استفاده از بتافرون در مولتیپل اسکلروزیس عود کننده- فروکش کننده و پیشرونده ثانویه می تواند فراوانی (30 درصد) و شدت تشدید بالینی را کاهش دهد. این بیماری، نیاز به درمان با گلوکوکورتیکواستروئیدها و همچنین کاهش تعداد بستری شدن در بیمارستان و طولانی شدن مدت بهبودی.
هنگام درمان با بتافرون در بیماران مبتلا به مولتیپل اسکلروزیس پیشرونده ثانویه، پیشرفت بیشتر بیماری و شروع ناتوانی (از جمله ناتوانی شدید، که در آن بیماران باید دائماً از ویلچر استفاده کنند) تا 12 ماه تاخیر داشت. اثر مشابهی در بیماران با یا بدون تشدید بیماری و همچنین با هر شاخص ناتوانی رخ می دهد (این مطالعه با مشارکت بیماران با امتیاز 3-6.5 انجام شد).
نتایج MRI مغز بیماران مبتلا به مولتیپل اسکلروزیس پیشرونده و عودکننده ثانویه موید این واقعیت است که درمان با دارو بر شدت بیماری تأثیر مثبت دارد. فرآیند پاتولوژیکو خطر تشکیل ضایعات فعال جدید را به میزان قابل توجهی کاهش می دهد.
مطالعات سمیت حاد دارو انجام نشده است. مطالعات مسمومیت با دوز مکرر در میمونهای رزوس احتمال هیپرترمی گذرا را نشان میدهد که با کاهش گذرا مشخص در تعداد نوتروفیلها و پلاکتها و افزایش گذرا در غلظت لنفوسیتها همراه است.
مطالعات سمیت تولید مثلی که در میمونهای رزوس انجام شده است نشان داده است که بتافرون نه تنها برای مادر سمی است، بلکه بروز سقطهای خود به خودی را نیز افزایش میدهد. با این حال، هیچ نقص رشدی در فرزندان زنده مشاهده نشد.
مطالعاتی در مورد تأثیر این دارو بر باروری انجام نشده است و هیچ تأثیری بر چرخه فحلی میمون ها ثبت نشده است.
یک مطالعه سمیت ژنی جداگانه (تست ایمز) نتوانست هیچ گونه اثر جهش زایی را تشخیص دهد.
مطالعات سرطان زایی نیز انجام نشده است و نتایج حاصل از آزمایش تبدیل سلولی در شرایط آزمایشگاهی هیچ پتانسیل سرطان زایی را نشان نداد.
با تجویز زیر جلدی دوزهای توصیه شده بتافرون (0.25 میلی گرم)، غلظت سرمی اینترفرون بتا-lb کم است یا اصلاً قابل تشخیص نیست. به همین دلیل است که هیچ اطلاعاتی در مورد فارماکوکینتیک دارو در بیماران مبتلا به مولتیپل اسکلروزیس دریافت کننده دوزهای توصیه شده از دارو وجود ندارد.
هنگامی که دوز 0.5 میلی گرم به صورت زیر جلدی تجویز می شود، حداکثر غلظت پلاسما 1 تا 8 ساعت پس از تزریق مشاهده می شود و تقریبا 40 IU/ml است. فراهمی زیستی مطلق دارو هنگام تجویز زیر جلدی تقریباً 50٪ است.
در تجویز داخل وریدیکلیرانس و نیمه عمر بتافرون از سرم به ترتیب 30 میلی لیتر در دقیقه بر کیلوگرم و 5 ساعت است.
تزریق بتافرون یک روز در میان باعث افزایش غلظت اینترفرون بتا-lb در پلاسمای خون نمی شود و فارماکوکینتیک دارو در کل دوره درمان تغییر نمی کند.
تجویز زیر جلدی دارو یک روز در میان با دوز 0.25 میلی گرم منجر به افزایش قابل توجهی در محتوای نشانگرهای پاسخ بیولوژیکی (اینترلوکین-10، نئوپترین، سیتوکین سرکوب کننده ایمنی، بتا2-میکروگلوبولین) در مقایسه با مقادیر پایه 6-12 ساعت می شود. پس از اولین دوز دارو. این شاخص پس از 40 تا 124 ساعت به اوج خود رسید و در کل دوره مطالعه (7 روز یا 168 ساعت) بالا باقی ماند.
موارد مصرف
- سندرم بالینی ایزوله (یک دوره بالینی منفرد از دمیلینه شدن که در صورت حذف تشخیص های جایگزین، نشان دهنده مولتیپل اسکلروزیس است).
- مولتیپل اسکلروزیس پیشرونده ثانویه با یک دوره فعال بیماری، از جمله تشدید یا بدتر شدن قابل توجه عملکردهای عصبی در چند سال گذشته (استفاده از بتافرون می تواند دفعات و شدت چنین تشدیدهایی را کاهش دهد و همچنین سرعت پیشرفت بیماری را کاهش دهد. بیماری)؛
- ام اس عود کننده-فرودکننده. این دارو برای کاهش فراوانی و شدت تشدید بیماری در بیماران سرپایی (توانایی حرکت بدون کمک) با سابقه حداقل دو تشدید بیماری در دو سال اخیر و به دنبال آن بهبودی (کامل یا ناقص) موثر است. علائم عصبی
موارد منع مصرف
استفاده از دارو در دوران بارداری، شیردهی و حساسیت به اجزای موجود در دارو منع مصرف دارد.
هنگام تجویز دارو برای بیماران مبتلا به بیماری قلبی و همچنین ترومبوسیتوپنی، کم خونی، اختلال عملکرد کبد، افسردگی و سابقه افکار خودکشی احتیاط لازم است.
تجربه با بتافرون در کودکان محدود است.
دستورالعمل استفاده از Betaferon: روش و دوز
درمان باید زیر نظر یک پزشک مجرب شروع شود.
اثرات جانبی
هنگام استفاده از Betaferon، مختلف اثرات جانبی. از طرف بدن به طور کلی، آنها معمولاً خود را به صورت آستنی، ضعف عمومی، واکنش در محل تزریق، سردرد، درد قفسه سینه، تب، لرز، درد شکم، درد نشان می دهند. محلی سازی های مختلفنکروز در محل تزریق، مجموعه ای از علائم شبیه آنفولانزا، که در طول ایجاد آن، پزشک ممکن است داروهای ضد التهابی غیر استروئیدی را تجویز کند.
این دارو ممکن است برخی از واکنش های پوستی را ایجاد کند که معمولاً به صورت بثورات و ضایعات پوستی ظاهر می شود.
علاوه بر این، در طول درمان با بتافرون، اختلالات سیستم قلبی عروقی، عضلانی-اسکلتی، عصبی، گوارشی، ادراری، تنفسی و تولید مثلی بدن ممکن است با فرکانس های متفاوت رخ دهد.
مصرف بیش از حد
هنگامی که بتافرون با دوز 5.5 میلی گرم 3 بار در هفته تجویز می شود، عوارض جانبی شدید در بیماران بزرگسال مبتلا به بیماری های انکولوژیکمشاهده نشدند.
دستورالعمل های ویژه
بتافرون حاوی آلبومین انسانی است، بنابراین خطر بسیار کمی برای انتقال بیماری های ویروسی وجود دارد.
برای بیماران در طول درمان، علاوه بر استاندارد تست های آزمایشگاهیتوصیه می شود به طور منظم یک آزمایش خون دقیق انجام دهید. بیماران مبتلا به کم خونی، لکوپنی و ترومبوسیتوپنی نیز ممکن است نیاز به نظارت دقیق تری از شمارش کامل خون، از جمله تعیین تعداد گلبول های سفید، گلبول های قرمز، پلاکت ها و فرمول لکوسیت.
در 1 بطری اینترفرون بتا-1b - 0.30 میلی گرم (یا 9.6 میلیون واحد بین المللی). آلبومین انسانی و مانیتول به عنوان مکمل استفاده می شود.
فرم انتشار
لیوفیلیزه برای تهیه محلول یا سوسپانسیون 9.6 میلیون واحد در یک بطری.
اثر فارماکولوژیک
تعدیل کننده ایمنی.
فارماکودینامیک و فارماکوکینتیک
فارماکودینامیک
ماده شیمیایی فعال اینترفرون بتا-1b دارای اثرات ضد ویروسی و تعدیل کننده ایمنی است. مکانیسم اثر آن به طور کامل مشخص نشده است، اما مشخص است که با تعامل با گیرنده های خاصی همراه است. اتصال به این گیرنده ها باعث بیان موادی می شود که در خون بیماران دریافت کننده این دارو شناسایی شده است. اینترفرون بتا اثر سرکوبگر سلول های تک هسته ای خون را افزایش می دهد.
در بیماران با فرم پیشرونده ثانویه RS استفاده از دارو پیشرفت بیماری و ناتوانی را تا یک سال به تاخیر می اندازد. نتایج ام آر آی مغز بیماران پویایی مثبت را تأیید می کند: کاهش در تشکیل ضایعات جدید. سمیت و سرطان زایی دارو مورد مطالعه قرار نگرفته است. آزمایش تبدیل سلولی انجام شد درونکشتگاهی ، اثرات سرطان زایی را نشان نداد.
فارماکوکینتیک
هنگامی که به صورت زیر جلدی در دوز 1 میلی لیتر (0.25 میلی گرم) غلظت تجویز می شود اینترفرون بتا در خون کم یا غیرقابل تشخیص هستند، بنابراین هیچ اطلاعاتی در مورد فارماکوکینتیک وجود ندارد. با تجویز 0.5 میلی گرم، حداکثر غلظت پس از 1-8 ساعت تعیین می شود. فراهمی زیستی 50%. اگر دارو به صورت داخل وریدی تجویز شود، نیمه عمر آن 5 ساعت است.
تجویز زیر جلدی یک روز در میان باعث افزایش غلظت خون نمی شود. در استفاده زیر جلدییک روز در میان با دوز 0.25 میلی گرم، نشانگرهای پاسخ بیولوژیکی به طور قابل توجهی 6-12 ساعت پس از اولین دوز افزایش می یابد، پس از 40-125 ساعت به اوج خود می رسد و برای 168 ساعت بالا باقی می ماند.
موارد مصرف
- سندرم ایزوله با یک فرآیند التهابی واضح، که در آن نشانه هایی برای استفاده از داخل وریدی وجود دارد کورتیکواستروئیدها ، به منظور کاهش سرعت انتقال به قابل اعتماد RS . به طور معمول این بیماران مبتلا به تظاهرات بالینیبیش از یک شیوع در CNS ;
- ام اس عود کننده- فروکش کننده (به منظور کاهش فراوانی تشدیدها در حضور 2 یا بیشتر تشدید در طی 2 سال با بهبودی ناقص وضعیت عصبی)؛
- ام اس پیشرونده ثانویه که یک دوره فعال با تشدید بیش از 2 سال و بدتر شدن واضح وضعیت عصبی (به منظور کاهش دفعات تشدید و پیشرفت آهسته) دارد.
موارد منع مصرف
- افزایش حساسیت؛
- شیردهی
زمانی که با احتیاط استفاده کنید نارسایی قلبی مراحل III-IV, کم خونی , لکوپنی و اختلال عملکرد کبد
اثرات جانبی
واکنش های رایج:
- واکنش در محل تزریق (درد، پرخونی ، التهاب، )؛
- علائم شبه آنفولانزا (لرز، میالژی ).
واکنشهای نادر:
- بی حالی، درد قفسه سینه؛
- کم خونی , لکوپنی ;
- کاهش یا افزایش وزن؛
- یا ؛
- هیپرتونیسیته عضلات؛
- تشنج بیقراری، اقدام به خودکشی، ناتوانی عاطفی.
- ، افزایش دادن؛
- و برونکواسپاسم ;
- میالژی و آرترالژی ;
- حالت تهوع، استفراغ؛
- ، واکنش های آنافیلاکسی؛
- خارش، راش؛
- تخلفات چرخه قاعدگی.
واکنش های بسیار نادر:
- اتساع عروق ;
- منوراژی .
بتافرون، دستورالعمل استفاده (روش و دوز)
این دارو به صورت زیر جلدی تجویز می شود. برای حل کردن پودر اینترفرون بتا 1.2 میلی لیتر حلال به بطری وارد می شود. پودر بدون تکان دادن به خوبی حل می شود. اگر ذرات حل نشده وجود داشته باشد، نمی توان از محلول استفاده کرد.
بتافرون در اسکلروز چندگانه یک روز در میان 1 میلی لیتر محلول (0.25 میلی گرم) تزریق کنید اینترفرون بتا ). اگر یک تزریق فراموش شود، بلافاصله انجام می شود و تزریق بعدی، همانطور که انتظار می رود، پس از 48 ساعت انجام می شود. طول دوره توسط پزشک در مطالعات بالینی از 3 تا 5 سال تعیین می شود.
مصرف بیش از حد
حتی زمانی که دارو سه بار به صورت داخل وریدی 5.5 میلی گرم تجویز شد، هیچ واکنش جانبی قابل توجهی مشاهده نشد.
اثر متقابل
مطالعات تداخل با سایر داروها انجام نشده است. گلوکوکورتیکواستروئیدها ، به طور همزمان برای تشدید استفاده می شود، به خوبی تحمل می شود. استفاده از بتافرون با دیگران تعدیل کننده های ایمنی مورد مطالعه قرار نگرفته است. هنگام تجویز همراه با داروهایی که پاکسازی آنها به سیستم بستگی دارد، احتیاط کنید سیتوکروم P450 (داروهای ضد افسردگی، داروهای ضد صرع)، و همچنین داروهایی که بر خون سازی تأثیر می گذارند. با داروها در یک سرنگ مخلوط نکنید.
شرایط فروش
با نسخه.
شرایط نگهداری
درجه حرارت تا 25 درجه سانتیگراد.
بهترین قبل از تاریخ
آنالوگ های بتافرون
کد ATX سطح 4 مطابقت دارد:اینفیبتا , رونبتال , Extavia .
Catad_pgroup داروهای مورد استفاده برای ام اس
بتافرون - دستورالعمل استفاده
شماره ثبت:
نام تجاری دارو:
بتافرون
نام بین المللی غیرقانونی:
اینترفرون بتا-1b
شکل دوز:
لیوفیلیزه برای تهیه محلول برای تجویز زیر جلدی
ترکیب
هر بطری با جزء فعال حاوی: اینترفرون بتا-1b (IFN-بتا-1b) - 0.30 میلی گرم (مرتبط با 9.6 میلیون واحد بین المللی)، آلبومین انسانی - 15.00 میلی گرم، مانیتول - 15.00 میلی گرم.
1 میلی لیتر از محلول آماده شده حاوی 0.25 میلی گرم (8.0 میلیون واحد بین المللی) اینترفرون نوترکیب بتا-1b است.
1 میلی لیتر از حلال آبی برای تهیه محلول تزریقی حاوی 5.4 میلی گرم کلرید سدیم است.
شرح
لیوفیلیزه کنید: توده سفید لیوفیلیزه.
حلال: محلول شفاف و تقریبا بی رنگ.
محلول بازسازی شده: محلول کمی مادی تا مادی، بی رنگ یا رنگ زرد روشن.
گروه دارویی
سیتوکین. دارویی برای درمان مولتیپل اسکلروزیس.
کد ATH: L03AB08
خواص فارماکولوژیک
فارماکودینامیک
اینترفرون ها پروتئین هایی هستند که از خانواده سیتوکین ها هستند و دارای وزن مولکولی 15000 تا 21000 دالتون هستند. سه دسته از اینترفرون ها وجود دارد: اینترفرون آلفا، اینترفرون بتا و اینترفرون گاما که دارای فعالیت های بیولوژیکی متفاوت اما همپوشانی هستند. فعالیت اینترفرون بتا-1b به گونه خاص است، بنابراین مرتبط ترین اطلاعات دارویی در مورد اینترفرون بتا-1b را می توان از مطالعات کشت داده شده به دست آورد. سلول های انسانییا در مطالعات in vivo در انسان.
ماده فعال داروی Betaferon (اینترفرون بتا-1b) دارای فعالیت ضد ویروسی و تعدیل کننده ایمنی است. مکانیسم های اثر اینترفرون بتا-1b در مولتیپل اسکلروزیس (MS) به طور کامل ثابت نشده است. با این حال، مشخص شده است که اثر بیولوژیکی اینترفرون بتا-1b به واسطه تعامل آن با گیرنده های خاصی است که در سطح سلول های انسانی یافت می شود. اتصال اینترفرون بتا-1b به این گیرنده ها باعث بیان تعدادی از موادی می شود که به عنوان واسطه اثرات بیولوژیکی اینترفرون بتا-1b در نظر گرفته می شوند. محتوای برخی از این مواد در سرم و فراکسیون سلولی بیماران دریافت کننده اینترفرون بتا-1b تعیین شد. اینترفرون بتا-1b ظرفیت اتصال را کاهش می دهد و همچنین درونی سازی و تخریب گیرنده های گاما اینترفرون را افزایش می دهد. علاوه بر این، اینترفرون بتا-1b فعالیت سرکوبگر سلول های تک هسته ای خون محیطی را افزایش می دهد. مطالعات جداگانه در مورد اثر داروی بتافرون بر بیماری های قلبی عروقی، تنفسی و سیستم غدد درون ریزاجرا نشدند.
تحقیقات بالینی:
مولتیپل اسکلروزیس عودکننده-فرودکننده
در یک مطالعه بالینی که بر روی بیماران مبتلا به مولتیپل اسکلروزیس عودکننده-فرودکننده و قادر به راه رفتن بدون کمک انجام شد. ارزش پایه EDSS از 0 تا 5.5)، نشان داده شده است که درمان با بتافرون باعث کاهش فراوانی (30٪) و شدت تشدید بالینی بیماری، تعداد بستری شدن در بیمارستان به دلیل بیماری و همچنین طولانی شدن مدت بهبودی می شود. هیچ اطلاعاتی در مورد تأثیر درمان با بتافرون بر طول مدت عود یا ظهور علائم بین تشدیدها و همچنین در مورد پیشرفت بیماری در مولتیپل اسکلروزیس عودکننده-فرودکننده وجود ندارد.
ام اس پیشرونده ثانویه:
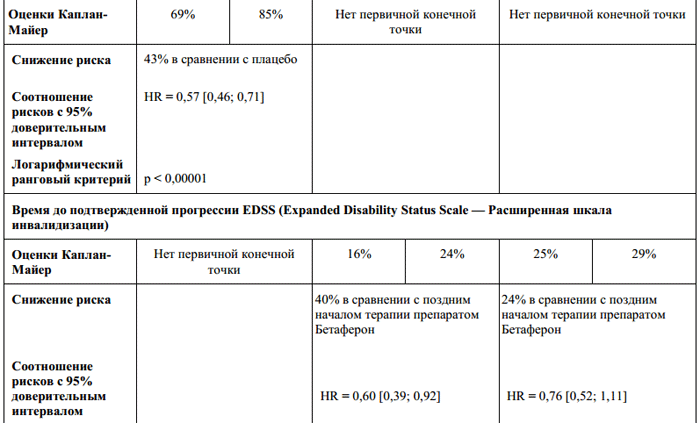
دو کارآزمایی بالینی کنترل شده شامل 1657 بیمار مبتلا به MS پیشرونده ثانویه (نمره پایه EDSS 3 تا 6.5، یعنی بیماران قادر به راه رفتن) انجام شد. بیماران مبتلا به درجه خفیفبیماریها و همچنین بیمارانی که قادر به حرکت نبودند، در مطالعات وارد نشدند. نتایج حاصل از هر دو مطالعه نتایج متناقضی را برای نقطه پایانی اولیه زمانی تا تایید پیشرفت بیماری پیشرفت تاخیری ناتوانی نشان داد.
در یکی از دو مطالعه، درمان با بتافرون تاخیر آماری معنیداری را در پیشرفت ناتوانی نشان داد (نسبت خطر = 0.69، 95٪ فاصله اطمینان(0.55؛ 0.86)، p = 0.0010 مربوط به کاهش 31٪ در خطر در نتیجه درمان با بتافرون) و ناتوانی شدید (به عنوان مثال، زمانی که بیماران مجبور به استفاده مداوم از ویلچر هستند) (نسبت خطر = 0.61، 95٪ اطمینان. فاصله زمانی (0.44؛ 0.85)، p = 0.0036 با کاهش 39 درصدی خطر در نتیجه درمان با بتافرون مطابقت دارد. این اثر طی 33 ماه در بیماران با هر شاخص ناتوانی، صرف نظر از فراوانی عود، مشاهده شد. در مطالعه دوم که شامل بیماران مبتلا به ام اس پیشرونده ثانویه بود، هیچ تاخیری در شروع ناتوانی در نتیجه درمان با بتافرون وجود نداشت. شواهدی وجود دارد که نشان میدهد بیماران شامل این مطالعهدر مقایسه با بیمارانی که در مطالعه اول شرکت کردند، در مرحله کمتر فعال بیماری بودند.
دادههای حاصل از یک متاآنالیز گذشتهنگر هر دو مطالعه یک اثر کلی آماری معنیدار درمان را نشان داد (0076/0=p؛ 8 میلیون واحد بینالمللی بتافرون در مقایسه با بیمارانی که دارونما دریافت میکردند).
تجزیه و تحلیل زیرگروهی گذشته نگر نشان داد که درمان با بتافرون به احتمال زیاد بر زمان ناتوانی در بیمارانی که قبل از درمان بیماری فعال داشتند (نسبت خطر 0.72، فاصله اطمینان 95٪ (0.59؛ 0.88)، P = بیشتر بود. 0011/0 به کاهش 28 درصدی خطر در نتیجه درمان با بتافرون در بیماران مبتلا به عود یا پیشرفت شدید EDSS مربوط می شود، 8 میلیون واحد بین المللی بتافرون در مقایسه با بیمارانی که دارونما دریافت می کنند. داده های حاصل از تجزیه و تحلیل گذشته نگر نشان می دهد که عود، و همچنین پیشرفت قابل توجه EDSS (EDSS > 1 امتیاز یا EDSS > 0.5 امتیاز برای EDSS > 6 در دو سال گذشته)، ممکن است به شناسایی بیماران مبتلا به بیماری فعال کمک کند.
در هر دو مطالعه بیماران مبتلا به مولتیپل اسکلروزیس پیشرونده ثانویه، درمان با بتافرون باعث کاهش 30 درصدی تشدید بالینی شد. هیچ داده ای در مورد تأثیر درمان بر طول مدت عود وجود نداشت.
سندرم ایزوله بالینی که نشان دهنده مولتیپل اسکلروزیس است
یک کارآزمایی بالینی کنترلشده در بیماران مبتلا به سندرم جدا شده بالینی و یافتههای تصویربرداری رزونانس مغناطیسی مغز (MRI) که حاکی از مولتیپل اسکلروزیس بود (حداقل دو ضایعه که از نظر بالینی در تصاویر MRI با وزن T2 مشخص نیستند) انجام شد. این مطالعه شامل بیمارانی با شروع بیماری تک کانونی یا چند کانونی (یعنی بیمارانی با تظاهرات بالینی یک یا حداقل دو ضایعه مرکزی بود. سیستم عصبی). بیمارانی که علائم هر بیماری مشابه بیماری ام اس را داشتند از مطالعه حذف شدند.
این مطالعه شامل 2 مرحله بود: یک مرحله کنترل شده با دارونما (دارونما در مقابل بتافرون) و سپس یک مرحله مشاهده از پیش برنامه ریزی شده. مرحله کنترل شده با دارونما 2 سال یا تا زمانی که بیماری ام اس قطعی بالینی (CDMS) ایجاد شد، هر کدام که زودتر اتفاق بیفتد، به طول انجامید. پس از اتمام مرحله کنترل شده با دارونما مطالعه، بیماران وارد مرحله پیگیری از پیش برنامه ریزی شده برای مقایسه اثرات شروع زودهنگام با شروع دیرهنگام درمان با بتافرون شدند. این مقایسه در بیمارانی که در ابتدا به صورت تصادفی در گروه بتافرون ("گروه بتافرون اولیه") و در گروه دارونما ("گروه دیررس") قرار گرفتند، انجام شد.
میز 1.
آرنتایج اثربخشی اولیه با توجه به مطالعه سود و نتایج پیگیری از مطالعهسود دنبال کردن- بالا.

در مرحله کنترل شده با دارونما مطالعه، بتافرون پیشرفت بیماری را از اولین تظاهرات بالینی به مولتیپل اسکلروزیس قابل توجه بالینی کند کرد. درمان با بتافرون باعث تاخیر پایدار در پیشرفت مولتیپل اسکلروزیس بر اساس معیارهای مک دونالد شد (جدول 1).
درمان با بتافرون بر پیشرفت بیماری به CDRS در تمام زیر گروههای آنالیز شده تأثیر داشت. بیماران با فرم تک کانونی و حداقل 9 ضایعه در تصاویر با وزن T2 یا افزایش Gd در MRI مغز پایه، در معرض خطر بالاتری برای پیشرفت به CDRS در طی 2 سال بودند. در بیماران مبتلا به فرم چند کانونی، زمان بروز بیماری قبل از CDRS به پارامترهای اولیه MRI بستگی ندارد، که بر اساس
مشاهدات بالینی خطر بالای CDRS را نشان دادپیشرفت بیماری بر این لحظههیچ تعریف روشنی وجود ندارد
درک مفهوم "ریسک بالا". یک رویکرد محافظه کارانه تر شامل شناسایی حداقل 9 ضایعه با وزن T2 در اسکن اولیه و حداقل یک ضایعه جدید با وزن T2 یا یک ضایعه جدید افزایش دهنده Gd حداقل یک ماه پس از اسکن اولیه است. در هر صورت، درمان فقط باید به بیماران در معرض خطر داده شود.
درصد بالایی از بیمارانی که مطالعه را تکمیل کردند (93٪ از گروه بتافرون) نشان داد که درمان با بتافرون به خوبی قابل تحمل است. برای افزایش تحمل دارو، تیتراژ دوز و تجویز داروهای ضد التهابی غیر استروئیدی در ابتدای درمان انجام شد. علاوه بر این، در طول مطالعه، اکثر بیماران دارو را با استفاده از یک اتوانژکتور دریافت کردند.
در مرحله پیگیری با برچسب باز، اثرات درمان پس از 3 و 5 سال درمان مشهود بود (جدول 1)، حتی اگر اکثر بیماران در گروه دارونما حداقل از سال دوم بیماری با بتافرون درمان شده بودند. در گروه با شروع زودهنگام درمان با بتافرون (جدول 1، اثر قابل توجه بعد از 3 سال، عدم اثر قابل توجهی پس از 5 سال)، پیشرفت بیماری در مقیاس EDSS (افزایش تایید شده در EDSS حداقل یک امتیاز نسبت به حالت اولیه) پایین تر بود اکثر بیماران در هر دو گروه پیشرفت ناتوانی را در طول 5 سال تجربه نکردند. برای «شروع زودهنگام درمان»، هیچ اثر ثابتی بر این پارامتر نتیجه نشان داده نشد. همانطور که توسط FAMS (ارزیابی عملکردی ام اس: شاخص درمان، نتیجه) اندازه گیری شد، به دلیل شروع زودهنگام درمان با بتافرون، هیچ مزیتی از نظر کیفیت زندگی وجود نداشت.
مولتیپل اسکلروزیس عودکننده- فروکش کننده، مولتیپل اسکلروزیس پیشرونده ثانویه، و سندرم جدا شده بالینی حاکی از مولتیپل اسکلروزیس.
نتایج MRI در بیماران مبتلا به مولتیپل اسکلروزیس اثربخشی بتافرون را نشان داد و پیشرفت بیماری را در تمام مطالعات کاهش داد. بر اساس نتایج ارزیابی ام آر آی، رابطه بین سیر مولتیپل اسکلروزیس و پیامد بالینی در حال حاضر نامشخص است.
ویژگی های سم شناسی
هیچ مطالعه سمیت حاد انجام نشده است. از آنجایی که جوندگان به اثرات اینترفرون بتا انسانی حساس نیستند، ارزیابی خطر بر اساس مطالعات سمیت دوز مکرر در میمونهای رزوس انجام شد. هیپرترمی گذرا همراه با افزایش گذرا مشخص در غلظت لنفوسیت ها و کاهش گذرا در پلاکت ها و نوتروفیل های قطعه بندی شده مشاهده شد.
مطالعات سمیت طولانی مدت انجام نشده است. مطالعات سمیت باروری در میمون های رزوس سمیت مادری و افزایش بروز سقط جنین خود به خود را نشان داده است. هیچ ناهنجاری در فرزندان زنده مشاهده نشد. هیچ مطالعه ای در مورد تأثیر بر باروری انجام نشده است. هیچ تاثیری بر چرخه فحلی میمون ها مشاهده نشد.
در یک مطالعه جداگانهسمیت ژنی (آزمون ایمز)، هیچ اثر جهش زایی مشاهده نشد. مطالعات سرطان زایی انجام نشده است. آزمایش تبدیل سلولی در شرایط آزمایشگاهی هیچ پتانسیل سرطان زایی را نشان نداد.
فارماکوکینتیک
غلظت پلاسمایی اینترفرون بتا-1b در بیماران و داوطلبان با استفاده از یک روش بیولوژیکی خاص تعیین شد.
پس از تجویز زیر جلدی 0.5 میلی گرم (16.0 میلیون واحد بین المللی) اینترفرون بتا-1b، حداکثر غلظت پلاسمایی 1-8 ساعت پس از تزریق به دست می آید و حدود 40 IU/ml است. با توجه به مطالعات مختلف، با تزریق داخل وریدی اینترفرون بتا-1b، کلیرانس و نیمه عمر پلاسما به ترتیب 30 میلی لیتر در دقیقه بر کیلوگرم و 5 ساعت است.
تجویز داروی بتافرون یک روز در میان منجر به افزایش غلظت اینترفرون بتا-1b در پلاسمای خون نمی شود و فارماکوکینتیک آن در طول دوره درمان تغییر نمی کند.
هنگامی که اینترفرون بتا-1b به صورت زیر جلدی تجویز می شود، فراهمی زیستی مطلق تقریباً 50٪ است.
نشانه های استفاده
سندرم ایزوله بالینی (CIS) (یک دوره بالینی دمیلیناسیون که نشان دهنده مولتیپل اسکلروزیس است، مشروط به حذف تشخیص های جایگزین) با شدت کافی فرآیند التهابیبرای تجویز کورتیکواستروئیدهای داخل وریدی – برای
کاهش سرعت انتقال به مولتیپل اسکلروزیس قطعی بالینی (CDMS) در بیماران در معرض خطر بالای ابتلا به CDMS.
هیچ تعریف پذیرفته شده ای از ریسک بالا وجود ندارد. طبق این مطالعه، گروه پرخطر برای ایجاد CDRS شامل بیماران مبتلا به CIS تک کانونی (تظاهرات بالینی 1 ضایعه در سیستم عصبی مرکزی) و 9 ضایعه در تصاویر با وزن T2 در MRI و/یا انباشته شدن ماده کنتراستکانون ها بیماران مبتلا به CIS چند کانونی (تظاهرات بالینی بیش از 1 ضایعه در سیستم عصبی مرکزی) بدون توجه به تعداد ضایعات در MRI در معرض خطر بالای ابتلا به CDRS هستند.
مولتیپل اسکلروزیس عودکننده- فروکش کننده (RRMS) - برای کاهش فراوانی و شدت تشدید در بیماران سرپایی (یعنی بیمارانی که قادر به راه رفتن بدون کمک هستند) با سابقه حداقل 2 تشدید در دو سال گذشته، و به دنبال آن ترمیم کامل یا ناقص بیماری های عصبی. کمبود.
مولتیپل اسکلروزیس پیشرونده ثانویه با یک دوره فعال بیماری که با تشدید یا بدتر شدن قابل توجه عملکردهای عصبی طی دو سال گذشته مشخص می شود - برای کاهش فراوانی و شدت تشدید بالینی بیماری و همچنین کاهش سرعت پیشرفت بیماری. .
موارد منع مصرف
- بارداری.
- شیر دادن.
- سابقه واکنش های حساسیت به اینترفرون بتا طبیعی یا نوترکیب و اجزای موجود در دارو.
- افسردگی شدید و/یا افکار خودکشی.
- بیماری های کبدی در مرحله جبران.
- دوران کودکیتا سن 18 سالگی (اطلاعات در مورد اثربخشی و ایمنی اینترفرون بتا-1b در کودکان محدود است).
با دقت
بتافرون در بیماران مبتلا به بیماری های زیر باید با احتیاط مصرف شود:
- بیماری قلبی، به ویژه، نارسایی قلبی کلاس عملکردی III-IV طبق طبقه بندی انجمن قلب نیویورک (NYHA)، کاردیومیوپاتی.
- حملات صرعیدر تاریخچه؛
- گاموپاتی مونوکلونال؛
- کم خونی، ترومبوسیتوپنی، لکوپنی؛
- نارسایی شدید کلیه
در بارداری و شیردهی استفاده شود
بارداری
اطلاعات در مورد توانایی بتافرون برای آسیب رساندن به جنین هنگام درمان زنان باردار یا تأثیر بر عملکرد تولید مثل انسان محدود است. در مطالعات بالینی کنترل شده، مواردی از سقط جنین خود به خود در بیماران مبتلا به مولتیپل اسکلروزیس گزارش شده است. استفاده از بتافرون در دوران بارداری منع مصرف دارد.
زنان در سنین باروری باید در طول درمان با بتافرون از روش های قابل اعتماد پیشگیری از بارداری استفاده کنند. اگر حاملگی در طول درمان یا هنگام برنامه ریزی بارداری رخ دهد، بیمار باید از خطر احتمالی جنین مطلع شود. در این مورد، توصیه می شود مصرف بتافرون را قطع کنید.
در بیمارانی که سابقه عود زیاد دارند، خطر عود جدی پس از قطع درمان با دارو در دوران بارداری باید قبل از شروع درمان در برابر خطر احتمالی سقط خودبخودی ارزیابی شود.
دوره شیردهی
مشخص نیست که آیا اینترفرون بتا-1b از آن ترشح می شود یا خیر شیر مادر. با توجه به احتمال نظری ایجاد عوارض جانبی به داروی بتافرون در نوزادان در شیر دادن، قطع شیردهی یا قطع دارو ضروری است.
روش کاربرد و دوزها
درمان با بتافرون باید تحت نظارت یک پزشک با تجربه در درمان مولتیپل اسکلروزیس شروع شود.
در ابتدای درمان معمولاً توصیه می شود دوز را افزایش دهید. درمان باید با تجویز 0.0625 میلی گرم (0.25 میلی لیتر) زیر جلدی یک روز در میان شروع شود و به تدریج دوز را به 0.250 میلی گرم (1.0 میلی لیتر) افزایش دهید، همچنین یک روز در میان تجویز شود. در صورت بروز هر گونه واکنش نامطلوب قابل توجه، دوره تیتراسیون دوز ممکن است تغییر کند. برای دستیابی به اثربخشی کافی درمان، دوز 0.250 میلی گرم (1.0 میلی لیتر) باید یک روز در میان تجویز شود.
جدول تیتراسیون دوز:
در مطالعات بالینی، مدت درمان در بیماران مبتلا به مولتیپل اسکلروزیس عود کننده-روکش کننده و ثانویه پیشرونده به ترتیب به 5 سال و 3 سال رسید.
در مولتیپل اسکلروزیس عودکننده-فرودکننده، اثربخشی درمان با بتافرون در دو سال اول درمان نشان داده شد. داده های موجود برای 3 مورد دیگر دوره تابستاندرمان با داده های مربوط به اثربخشی درمان با بتافرون در کل دوره درمان سازگار است.
در بیماران مبتلا به سندرم جدا شده بالینی که نشان دهنده مولتیپل اسکلروزیس است، پیشرفت بیماری به CDRS طی یک دوره 5 ساله به تعویق افتاد.
انجام درمان با بتافرون در بیماران مبتلا به مولتیپل اسکلروزیس عود کننده-فرودکننده که کمتر از دو بار عود در طی 2 سال گذشته داشته اند و در بیماران مبتلا به مولتیپل اسکلروزیس پیشرونده ثانویه که تجربه نکرده اند، توصیه نمی شود. فاز فعالبیماری های 2 سال گذشته
درمان با بتافرون باید قطع شود اگر بیمار به درمان پاسخ ندهد، به عنوان مثال، پیشرفت مداوم بیماری در طی 6 ماه طبق مقیاس EDSS (امتیاز ناتوانی گسترده) یا علی رغم درمان با بتافرون، حداقل سه دوره درمان ACTH (هورمون آدرنوکورتیکوتروپیک) یا کورتیکواستروئیدها به مدت 1 سال مورد نیاز است.
تهیه محلول تزریقی
آ. بسته بندی دارو حاوی ویال و سرنگ های از پیش پر شده:
برای حل کردن پودر لیوفیلیزه اینترفرون بتا-1b برای تزریق، از سرنگ آماده همراه با حلال و سوزن استفاده کنید.
ب- بسته بندی دارو حاوی ویال، سرنگ های از پیش پر شده، آداپتور بطری با دستمال مرطوب سوزنی و الکلی:
برای حل کردن پودر لیوفیلیزه اینترفرون بتا-1b برای تزریق، از سرنگ آماده همراه با حلال و آداپتور ویال با سوزن استفاده کنید.
1.2 میلی لیتر حلال (محلول کلرید سدیم 0.54٪) همراه با داروی Betaferon به بطری وارد می شود. پودر باید بدون تکان دادن کاملا حل شود. قبل از استفاده، محلول نهایی را که باید کمی مادی تا مادی، بی رنگ یا زرد روشن باشد، بررسی کنید. در صورت وجود ذرات یا تغییر رنگ محلول، نباید از آن استفاده کرد.
محلول استفاده نشده باید دور ریخته شود.
1 میلی لیتر از محلول نهایی حاوی 0.25 میلی گرم (8 میلیون واحد بین المللی) اینترفرون بتا-1b است.
مقدار داروی مورد نیاز مطابق با دوز تیتر شده پس از تهیه محلول به داخل سرنگ کشیده می شود.
تکنیک خود تزریقی برای بیماران
برای تهیه محلول بتافرون برای تزریق و تزریق خود، لطفاً دستورالعمل ها را به دقت بخوانید و مرحله به مرحله آنها را دنبال کنید. پزشک یا پرستار شما را با روش و تکنیک خود تزریق آشنا می کند و به شما در یادگیری کمک می کند. تا زمانی که مطمئن نشده اید که الزامات آماده سازی محلول و همچنین تکنیک خود تزریقی را به درستی درک کرده اید، اقدام به تزریق نکنید.
الف- بسته بندی دارو حاوی ویال و سرنگ های از پیش پر شده.
- آماده سازی برای تزریق
- وارد کردن حجم مورد نیاز حلال (1.2 میلی لیتر) به داخل ویال با داروی بتافرون.
- حجم مورد نیاز محلول تزریقی (1.0 میلی لیتر) را به یک سرنگ اضافه کنید.
آماده سازی برای تزریق
1. قبل از تزریق، هر چیزی را که برای تزریق نیاز دارید جمع آوری کنید.
برای این شما نیاز خواهید داشت:
- سرنگ پر شده با حلال دارویی بتافرون (محلول کلرید سدیم 0.54 درصد)
- بطری با داروی بتافرون
- سوزن 21 گرم
- سوزن 30 گرم
- دستمال مرطوب الکلی
- ظرف برای سرنگ و سوزن استفاده شده
2. دست های خود را کاملا با صابون بشویید.
3. درپوش محافظ را با بتافرون از بطری بردارید.
4. درب بطری را با بتافرون با دستمال مرطوب الکلی پاک کنید (در یک جهت پاک کنید و از یک دستمال مرطوب استفاده کنید).
نکته: دستمال الکلی را روی درب بطری بگذارید و تا زمانی که آماده استفاده از بطری نشده اید، آن را بردارید.
وارد کردن حجم مورد نیاز حلال (1.2 میلی لیتر) به داخل ویال با داروی بتافرون
توجه: بطری بتافرون را بردارید و پد الکلی را در بالا دور بریزید.
1. با دستان خود روی یک سطح ثابت، سرنگ حلال را از بسته بندی آن خارج کنید. درپوش را بکشید تا از پایه سرنگ خارج شود. نوک باز سرنگ را لمس نکنید. پیستون را فشار ندهید.
2. سوزن 21G را از بسته بندی خارج کرده و آن را محکم روی نوک سرنگ قرار دهید. درپوش محافظ را از سوزن بردارید. به سوزن دست نزنید.
3. پس از قرار دادن بطری با بتافرون روی یک سطح ثابت، سوزن سرنگ (حاوی 1.2 میلی لیتر حلال) را به آرامی از درب بطری وارد کنید.
4. به آرامی پیستون را به سمت پایین فشار دهید. سوزن باید به این طرف هدایت شود
به طوری که مایع به سمت دیواره بطری جریان یابد (اگر حلال را مستقیماً وارد کنید
پودر، کف زیادی تشکیل می شود).
5. مراقب باشید که اجازه ندهید سوزن با هیچ پودر یا
راه حل.
6. هنگامی که تمام محتویات سرنگ را در بطری بتافرون تزریق کردید، بطری را بین انگشتان شست، اشاره و وسط خود نگه دارید تا سوزن و سرنگ روی دست شما قرار گیرد.
7. بطری را با دقت بچرخانید تا پودر بتافرون کاملا حل شود. تکان نخورید!
8. محلول را به دقت بررسی کنید (باید شفاف باشد).
توجه: اگر مخلوط حاوی ذرات است یا تغییر رنگ داده است، آن را دور بیندازید و کل مراحل را از ابتدا شروع کنید.
حجم مورد نیاز محلول تزریقی (1.0 میلی لیتر) را در یک سرنگ تنظیم کنید
توجه: قبل از تهیه محلول آماده شده، پیستون سرنگ را به طور کامل فشار دهید تا هوای موجود در داخل سرنگ خارج شود.
1. بطری را با محلول بتافرون کمی کج کنید و نوک سوزن را داخل آن قرار دهید.
پایین ترین نقطه بطری
توجه: مطمئن شوید که نوک سوزن همیشه در محلول باشد.
2. پیستون را بکشید و 1.0 میلی لیتر مایع را به داخل سرنگ بکشید.
3. بطری را وارونه کنید و سرنگ را طوری نگه دارید که سوزن به سمت بالا باشد.
4. به آرامی روی سرنگ ضربه بزنید تا حباب های هوا به داخل سرنگ منتقل شود قسمت بالاسیلندر.
5. به آرامی پیستون را فشار دهید تا ONLY AIR از سرنگ خارج شود.
6. سرنگ را از سوزن جدا کنید. سوزن را در بطری بگذارید.
7. سرنگ (بدون سوزن) را روی یک سطح صاف قرار دهید. اطمینان حاصل کنید که نوک سرنگ با سطح تماس نداشته باشد.
8. یک سوزن 30 گرمی بردارید، آن را از بسته بردارید و محکم روی نوک سرنگ قرار دهید.
9. بطری را با محلول باقیمانده و سوزن دور بیندازید.
اکنون آماده تزریق هستید.
ب- بسته بندی دارو حاوی ویال، سرنگ های از پیش پر شده، آداپتور ویال با سوزن و دستمال مرطوب الکلی.
مراحل تهیه محلول:
1- قبل از شروع عمل، دست های خود را کاملا با صابون بشویید.
2 - بطری بتافرون را - ترجیحاً نه با ناخن چون ممکن است بشکند بلکه با انگشت شست - باز کنید و روی میز بگذارید.

3 - درب بطری را با دستمال الکلی پاک کنید. دستمال را فقط در یک جهت حرکت دهید و سپس آن را روی درب بطری بگذارید.

4 – بسته تاول حاوی آداپتور بطری را باز کنید، اما آداپتور را داخل آن بگذارید.
آداپتور ویال را از بسته بلستر خارج نکنید.بسته بندی.
همچنین مراقب باشید که آداپتور ویال را لمس نکنید. مهم است که استریل باقی بماند.

5- در حین اتصال آداپتور، بطری را روی سطح صاف نگه دارید.
6 - دستمال مرطوب الکلی را از درب ویال بتافرون بردارید. بسته تاول حاوی دستگاه انتقال محلول با آداپتور بطری را روی درب بطری قرار دهید. تاول بزرگ را فشار دهید انگشتان اشارهیا با کف دست خود تا زمانی که صدای کلیک را بشنوید.

7 - با استفاده از لبه های بسته تاول، آن را از آداپتور بطری جدا کنید. اکنون آماده هستید تا سرنگ حلال از پیش پر شده را به پیوست انتقال محلول وصل کنید.

8 - سرنگ را بردارید. درپوش نارنجی را روی نوک سرنگ بچرخانید و آن را از سرنگ بیرون بکشید. درپوش را دور بریزید.

9 - سرنگ را به سوراخ کنار آداپتور وصل کنید و نوک سرنگ را داخل آن قرار دهید و با فشار دادن و در حین چرخش در جهت عقربه های ساعت (مانند فلش) با دقت محکم کنید تا مجموعه سرنگ تشکیل شود.

10 - ساختار سرنگ را از ته بطری نگه دارید. به آرامی پیستون سرنگ را تا انتها فشار دهید تا تمام حلال به داخل ویال منتقل شود. پیستون را رها کنید. در این حالت پیستون می تواند به موقعیت اولیه خود بازگردد.

11 - چندین حرکت چرخشی دقیق با بطری انجام دهید تا پودر خشک بتافرون کاملا حل شود. در این مورد، ساختار با سرنگ به بطری چسبیده باقی می ماند.
بطری را تکان ندهید.

12 - محلول را به دقت بررسی کنید. باید شفاف باشد و حاوی ذرات نباشد. اگر
محلول تغییر رنگ داده یا حاوی ذرات است، آن را بیرون بریزید و کل روش را از ابتدا با یک بسته جدید لوازم جانبی شروع کنید. اگر کف ظاهر شود، اگر بطری تکان بخورد یا چه اتفاقی می افتد
بیش از حد بچرخانید - بگذارید بطری بماند تا کف ته نشین شود.
آماده کردن سرنگ

13 - اگر پیستون به حالت اولیه خود بازگشته است، دوباره آن را به داخل فشار داده و قفل کنید. برای تهیه تزریق، ساختار را برگردانید تا بطری در بالا و درب بطری به سمت پایین باشد. این اجازه می دهد تا محلول به داخل سرنگ تخلیه شود.
سرنگ را به صورت افقی نگه دارید.
به آرامی پیستون را عقب بکشید تا تمام محلول از ویال به داخل سرنگ کشیده شود.
14 - ساختار سرنگ را بچرخانید تا سوزن به سمت بالا باشد. این امر باعث بالا آمدن حباب های هوا به سطح محلول می شود.

15 - حباب های هوا را با ضربه آرام بر روی سرنگ و حرکت پیستون به نقطه 1 میلی لیتر یا بیشتر بردارید.
حجم تجویز شده توسط پزشک
اگر مقدار زیادی محلول همراه با حباب های هوا به داخل ویال ریخته شده است، پیستون را کمی به عقب بکشید تا محلول از ویال به داخل سرنگ برگردد. این کار را تا زمانی انجام دهید که تمام هوا خارج شود و سرنگ حاوی 1 میلی لیتر از محلول آماده شده باشد.
یادداشت مهم : هنگام کشیدن مجدد محلول، ساختار را با سرنگ به حالت افقی و بطری در بالا برگردانید.

16 - پس از این، آداپتور بطری آبی را به همراه بطری متصل به آن بگیرید.
آداپتور را به سمت خود بچرخانید و سپس آن را از سرنگ جدا کنید.
هنگام جدا کردن آداپتور ویال از سرنگ، فقط آداپتور پلاستیکی آبی را بگیرید. سرنگ را افقی نگه دارید؛ بطری باید زیر سرنگ باشد.

17 - با جدا کردن بطری و آداپتور از سرنگ، محلول در حین تزریق از سوزن خارج می شود.
18 - اکنون آماده تزریق هستید.
توجه: دارو باید بلافاصله پس از تهیه محلول به صورت زیر جلدی تجویز شود. اگر تزریق به تعویق افتاد، محلول باید در یخچال نگهداری شود و در مدت 3 ساعت استفاده شود.
19 - بطری و محلول استفاده نشده باقیمانده را در ظرفی برای
هدر.
توضیح کوتاهآماده سازی دارو برای تزریق
1. محتویات را از بسته بندی خارج کنید.
2. آداپتور بطری را به بطری وصل کنید.
3. سرنگ را به آداپتور ویال وصل کنید.
4. پیستون را فشار دهید تا حلال به داخل ویال منتقل شود.
5. مجموعه سرنگ را برگردانید، سپس پیستون را عقب بکشید.
6. ویال را از سرنگ جدا کنید - اکنون آماده تزریق هستید.
توجه: دارو باید بلافاصله پس از تهیه محلول به صورت زیر جلدی تجویز شود. اگر تزریق به تعویق افتاد، محلول باید در یخچال نگهداری شود و در مدت 3 ساعت استفاده شود.
انتخاب و تهیه محل تزریق و تجویز محلول دارویی
بتافرون (1.0 میلی لیتر) به صورت زیر جلدی
- انتخاب محل تزریق
داروی Betaferon (اینترفرون بتا-1b) باید به صورت زیر جلدی تجویز شود. مناطق نرم دور از مفاصل و اعصاب برای این منظور بهترین هستند.
محل های تزریق را می توان با استفاده از نقاشی انتخاب کرد. بهتر است ابتدا محل تزریق مشخص شود و سپس سرنگ آماده شود.
اگر رسیدن به جایی برایتان سخت است، از فردی که می داند چگونه تزریق کند کمک بخواهید.
1 - محل تزریق را انتخاب کنید (شکل "طرح تزریق های متناوب انجام شده" را در انتهای دستورالعمل ببینید).
یادداشت مهم: در مناطقی که برجستگی، تورم، گره سفت یا درد وجود دارد تزریق نکنید. علاوه بر این، محلول نباید در مناطقی که تغییر در رنگ پوست، فرورفتگی، پوسته پوسته یا یکپارچگی پوست به خطر افتاده است، تزریق شود. اگر متوجه این یا سایر شرایط غیرعادی شدید، با ارائه دهنده مراقبت های بهداشتی خود تماس بگیرید.
2- پوست محل تزریق را با دستمال الکلی پاک کنید و صبر کنید تا پوست در معرض هوا قرار گیرد تا خشک شود. دستمال را دور بیندازید.
برای ضد عفونی کردن پوست از یک ضد عفونی کننده مناسب استفاده کنید.

3 - درپوش محافظ را از سوزن بردارید. درپوش را به جای پیچاندن آن بکشید.
4- پوست اطراف ناحیه ضدعفونی شده را به آرامی نیشگون بگیرید (تا کمی بلند شود).

5- با یک حرکت تیز و مطمئن سوزن را مستقیماً با زاویه 90 درجه وارد پوست کنید. سرنگ را مانند مداد نگه دارید یا
دارت
6- با اعمال فشار ملایم و مداوم بر روی پیستون محلول را به آرامی تزریق کنید. (پیستون را تا آخر فشار دهید تا سرنگ خالی شود.)
7- سرنگ را در ظرف زباله بیندازید.
- محل های تزریق متناوب
لازم است هر بار یک محل تزریق جدید انتخاب کنید، زیرا محل های تزریق متناوب اجازه می دهد تا پوست بهبود یابد و همچنین به جلوگیری از عفونت کمک می کند. بهتر است محل تزریق را از قبل انتخاب کنید و تنها پس از آن سرنگ را آماده کنید. نمودار نشان داده شده در شکل به شما کمک می کند تا مکان های تزریق را به درستی جایگزین کنید. به عنوان مثال، اگر اولین تزریق را در نیمه راست شکم انجام دادید، سپس تزریق دوم را داخل شکم انجام دهید نیمه باقی مانده، سوم - در ران راست و غیره. مطابق نمودار تا زمانی که از تمام نقاط ممکن تزریق استفاده نکنید. محل و زمان آخرین تزریق خود را بنویسید.


طبق طرح پیشنهادی، پس از 8 بار تزریق (پس از 16 روز) به محل اولین تزریق (مثلاً نیمه راست شکم) برمی گردید. به این «چرخه تناوب» می گویند. در نموداری که به عنوان مثال ارائه می کنیم، هر ناحیه به نوبه خود به 6 محل تزریق (در مجموع 48 محل تزریق) تقسیم می شود: قسمت های چپ و راست، قسمت های فوقانی، مرکزی و پایین ناحیه مربوطه. هنگامی که پس از یک دوره تناوب به یکی از مناطق بازگشتید، دورترین محل تزریق ممکن را در آن ناحیه انتخاب کنید. اگر هر ناحیه ای دردناک شد، سایر نقاط احتمالی تزریق را با پزشک خود در میان بگذارید.
طرح جایگزینی:
برای کمک به جایگزینی صحیح محل های تزریق، توصیه می شود زمان و در کدام ناحیه تزریق را یادداشت کنید. برای انجام این کار، می توانید از طرح تناوب زیر استفاده کنید:
سیکل 1تناوب 8 تزریق اول به صورت متوالی از منطقه 1 تا منطقه 8 و تنها با استفاده از بخش بالای سمت چپ هر منطقه انجام می شود.
سیکل 2تناوب 8 تزریق بعدی دوباره از ناحیه 1 شروع می شود، اما باید در قسمت پایین سمت راست هر ناحیه انجام شود.
سیکل 3تناوب 8 تزریق بعدی در این چرخه با ناحیه 1 شروع می شود و به نوبه خود در بخش های مرکزی سمت چپ هر زون انجام می شود.
با دنبال کردن این ترتیب، هر ناحیه این فرصت را خواهد داشت تا قبل از تزریق بعدی، به طور کامل بهبود یابد.
ثبت تزریقات تکمیل شده
دستورالعمل ثبت مکان و تاریخ تزریق انجام شده
محل تزریق را انتخاب کنید. اگر از قبل از Betaferon استفاده می کنید، سپس با ناحیه ای که در آخرین چرخه چرخش استفاده نشده است، شروع کنید، یعنی. در 16 روز گذشته
پس از تزریق، محل مورد استفاده و تاریخ تزریق را یادداشت کنید (شکل "نمونه ثبت تزریق انجام شده" را در انتهای دستورالعمل استفاده ببینید).


عوارض جانبی
بروز عوارض جانبی معمولاً با شروع درمان همراه است. فراوانی وقوع آنها با گذشت زمان کاهش می یابد.
اغلب، مجموعه ای از علائم شبیه آنفولانزا (تب، لرز، آرترالژی، ضعف عمومی، تعریق، سردرد یا میالژی) ممکن است به دلیل عمل فارماکولوژیکداروی بتافرون توصیه می شود در ابتدای درمان دوز را تیتر کنید. با استفاده از داروهای ضد التهابی غیر استروئیدی می توان شدت علائم آنفولانزا را کاهش داد.
اغلب، بیماران پس از تجویز بتافرون با دوز 0.25 میلی گرم (8 میلیون واحد بین المللی) واکنش هایی را در محل تزریق تجربه می کنند (به عنوان مثال قرمزی، تورم، تغییر رنگ پوست، التهاب، درد، حساسیت مفرط، نکروز و واکنش های غیر اختصاصی).
بروز واکنش های محل تزریق ممکن است با استفاده از دستگاه تجویز خودکار دارو کاهش یابد.
عوارض جانبی (ARs) با استفاده از داروی بتافرون، که در طول کارآزماییهای بالینی مشاهده شده و در طی نظارت پس از ثبت نام شناسایی شدهاند، و فراوانی وقوع آنها در زیر ارائه شده است.
مناسب ترین واژه فرهنگ لغت پزشکی برای فعالیت های تنظیمی (MedDRA) برای توصیف یک واکنش خاص، مترادف های آن و شرایط مرتبط استفاده می شود.
میز 1: عوارض جانبی و ناهنجاری های آزمایشگاهی، مشاهده شده در طول آزمایشات بالینیبا میزان بروز ≥ 10% و سندرمی شامل حداقل دو مورد از عوارض جانبی زیر:
تب، لرز، میالژی، ضعف و تعریق؛
3 - انحراف از هنجار پارامترهای آزمایشگاهی؛
4
بتافرون در بیماران مبتلا به سندرم جدا شده بالینی، اجازه می دهد
پیشنهاد مولتیپل اسکلروزیس، ص< 0,05;
5
- عوارض جانبی به طور قابل توجهی با مصرف دارو مرتبط است
بتافرون در بیماران مبتلا به مولتیپل اسکلروزیس عودکننده-فرودکننده،
پ< 0,05;
6
- عوارض جانبی به طور قابل توجهی با مصرف دارو مرتبط است
بتافرون در بیماران مبتلا به مولتیپل اسکلروزیس پیشرونده ثانویه، ص< 0,05;
7
- هیچ تغییری در پروفایل در طول مطالعه بالینی BENEFIT مشاهده نشد
ایمنی داروی بتافرون
جدول 2: عوارض جانبی شناسایی شده در طی مشاهدات پس از ثبت نام، و فراوانی وقوع آنها مشخص شده است، بر اساس داده های تلفیقی از مطالعات بالینی تعیین می شود.
3 - برای تمام داروهای حاوی اینترفرون اعمال می شود (به ادامه مطلب مراجعه کنید
بتافرون دارویی است که در درمان مولتیپل اسکلروزیس استفاده می شود.
فرم انتشار و ترکیب
بتافرون به شکل لیوفیلیزه سفید با حلال بی رنگ شفاف موجود در کیت، به ترتیب در بطری های شیشه ای 9.6 میلیون واحد بین المللی و 1.2 سرنگ تولید می شود. محلول تمام شده شبیه یک مایع زرد کم رنگ یا بی رنگ است.
یک بطری بتافرون حاوی 9.6 میلیون واحد بین المللی اینترفرون بتا-1b نوترکیب و مواد جانبی زیر است - مانیتول و آلبومین انسانی. حلال حاوی محلول کلرید سدیم 0.54 درصد استریل است.
موارد مصرف
طبق دستورالعمل، بتافرون برای درمان سندرم بالینی ایزوله، کاهش شدت تشدید و دفعات مولتیپل اسکلروزیس عودکننده-فرودکننده و مولتیپل اسکلروزیس پیشرونده ثانویه تجویز میشود.
موارد منع مصرف
استفاده از بتافرون در دوران بارداری و همچنین در موارد حساسیت بیش از حد بیمار به هر یک از اجزای دارو و در طول دوره شیردهی ممنوع است.
این دارو برای اختلال عملکرد کبد، سابقه حملات صرع، بیماری قلبی، کم خونی، افسردگی، ترومبوسیتوپنی، افکار خودکشی و همچنین برای بیماران زیر 18 سال با احتیاط تجویز می شود.
دستورالعمل استفاده و مقدار مصرف
این دارو به صورت زیر جلدی و زیر نظر پزشک تجویز می شود. دوز محصول 250 میکروگرم است که معادل یک میلی لیتر از محلول نهایی است. تزریقات به شدت هر 48 ساعت یکبار انجام می شود. مدت زمان درمان با بتافرون توسط پزشک تعیین می شود به طور جداگانهو می تواند از 3 تا 5 سال طول بکشد.
اثرات جانبی
در صورت استفاده، بتافرون می تواند عوارض جانبی در برخی از سیستم های بدن ایجاد کند، یعنی:
- فشار خون شریانی، تاکی کاردی، اتساع عروق، کاردیومیوپاتی و تپش قلب (سیستم قلبی عروقی)؛
- درد شکمی، تهوع، پانکراتیت، استفراغ، افزایش فعالیت آسپارتات آمینوترانسفراز و آلانین آمینوترانسفراز، هپاتیت و اسهال (سیستم گوارشی).
- لنفوسیتوپنی، کم خونی، نوتروپنی، لکوپنی، ترومبوسیتوپنی و لنفادنوپاتی (سیستم خونساز).
- میاستنی گراویس، آرترالژی، میالژی و گرفتگی عضلات پا (سیستم اسکلتی عضلانی)؛
- تنگی نفس و برونکواسپاسم (سیستم تنفسی)؛
- فوریت های ادراری (سیستم ادراری)؛
- متروراژی، منوراژی، بی نظمی قاعدگی و ناتوانی جنسی (سیستم تولید مثل)؛
- اختلال عملکرد غده تیروئیدپرکاری تیروئید و کم کاری تیروئید (سیستم غدد درون ریز)؛
- افزایش سطح تری گلیسیرید (متابولیسم).
همچنین، طبق دستورالعمل، بتافرون باعث عوارض و واکنش های زیر می شود:
- بی خوابی، سرگیجه، هیپرتونیک عضلانیبی اشتهایی، اقدام به خودکشی، افسردگی، بیقراری، سردرگمی، ناتوانی عاطفی و ناهماهنگی (سیستم عصبی مرکزی)؛
- واکنش های آنافیلاکتیک ( عکس العمل های آلرژیتیک);
- هیپرمی، تورم موضعی، التهاب، درد و نکروز در محل تزریق (واکنش های موضعی).
- آلوپسی، کهیر، بثورات پوستی، خارش و تغییر رنگ پوست (واکنش های پوستی)؛
- استنی، سردرد، کسالت عمومی، تب، درد شکم و قفسه سینه، لرز و علائم شبه آنفولانزا (در کل بدن).
دستورالعمل های ویژه
بلافاصله قبل از شروع درمان، و همچنین به طور منظم در کل دوره استفاده از Betaferon، توصیه می شود یک آزمایش خون دقیق و نظارت بر عملکرد کبد انجام دهید. در مواردی که افزایش قابل توجهی در ترانس آمینازهای کبدی مشاهده شود، مصرف دارو باید قطع شود.
مهم است که به بیماران اطلاع داده شود که بتافرون ممکن است عوارض جانبی مانند افکار خودکشی و افسردگی ایجاد کند.
این دارو باعث ایجاد اثرات نامطلوب بر روی سیستم عصبی مرکزی می شود، بنابراین بیماران باید در هنگام تجویز مراقب باشند مکانیسم های پیچیدهو وسایل نقلیه موتوری
داروی رقیق شده باید بلافاصله استفاده شود.
آنالوگ ها
مترادف این دارو، داروی Betfer-1B است. آنالوگ های بتافرون داروهایی مانند:
- آلفارکین;
- بیوفرون؛
- ویروگل؛
- جنفاکسون;
- اینگارون;
- لافروبیون;
- نازوفرون;
- پگینترون;
- Realdiron;
- سفرون؛
- ابرون آلفا آر;
- یونیترون.
شرایط و ضوابط نگهداری
بتافرون طبق دستورالعمل باید در جای خشک، دور از دسترس کودکان و نور، در دمای بین 15 تا 25 درجه سانتیگراد نگهداری شود.
این دارو با تجویز پزشک از داروخانه ها صادر می شود. ماندگاری دارو دو سال است. پس از اتمام تاریخ انقضا، محصول دارویی باید دور ریخته شود. حلال به مدت سه سال ذخیره می شود.
بتافرون- اولین دارویی که به طور خاص برای درمان مولتیپل اسکلروزیس توسعه یافته و فقط برای این نشانه ثبت شده است.
درمان با بتافرون هم در مولتیپل اسکلروزیس عودکننده- فروکش کننده و هم در مولتیپل اسکلروزیس پیشرونده ثانویه، فراوانی (30%) و شدت تشدید بالینی بیماری، تعداد بستری شدن در بیمارستان و نیاز به درمان با گلوکوکورتیکواستروئیدها را کاهش می دهد و همچنین طول مدت بهبودی را طولانی می کند. .
در بیماران مبتلا به ام اس پیشرونده ثانویه، درمان با بتافرون می تواند پیشرفت بیشتر بیماری و شروع ناتوانی، از جمله ناتوانی شدید (یعنی زمانی که بیماران مجبور به استفاده مداوم از ویلچر هستند) را تا 12 ماه به تاخیر بیندازد. این تأثیر در بیماران با تشدید بیماری و بدون تشدید و همچنین با هر شاخص ناتوانی مشاهده می شود (این مطالعه شامل بیمارانی با امتیاز 3.0 تا 6.5 در مقیاس ارزیابی ناتوانی گسترده بود).
نتایج تصویربرداری رزونانس مغناطیسی از مغز بیماران مبتلا به مولتیپل اسکلروزیس عود کننده- فروکش کننده و ثانویه پیشرونده در طول درمان با بتافرون، تأثیر مثبت قابل توجه دارو را بر شدت فرآیند پاتولوژیک و همچنین کاهش قابل توجهی در تشکیل مولتیپل اسکلروزیس تایید می کند. ضایعات فعال جدید
خواص دارویی
فارماکودینامیک. ماده فعال داروی بتافرون (اینترفرون بتا-lb) دارای فعالیت ضد ویروسی و تعدیل کننده ایمنی است. مکانیسم های اثر اینترفرون بتا-1b در مولتیپل اسکلروزیس (MS) به طور کامل ثابت نشده است. با این حال، مشخص شده است که اثر بیولوژیکی اینترفرون بتا-1b به واسطه تعامل آن با گیرنده های خاصی است که در سطح سلول های انسانی یافت می شود. اتصال اینترفرون بتا به این گیرنده ها باعث بیان تعدادی از مواد می شود که به عنوان واسطه اثرات بیولوژیکی اینترفرون بتا-1K در نظر گرفته می شوند. اینترفرون بتا-1K اینترفرون بتا ظرفیت اتصال گیرنده گاما اینترفرون را کاهش می دهد و درونی سازی و تخریب آن را افزایش می دهد. علاوه بر این، اینترفرون بتا-1b فعالیت سرکوبگر سلول های تک هسته ای خون محیطی را افزایش می دهد.
هیچ مطالعه سمیت حاد انجام نشده است. از آنجایی که جوندگان به اثرات اینترفرون بتا انسانی حساس نیستند، ارزیابی خطر بر اساس مطالعات سمیت دوز مکرر در میمونهای رزوس انجام شد. هیپرترمی گذرا همراه با افزایش گذرا مشخص در غلظت لنفوسیت ها و کاهش گذرا در پلاکت ها و نوتروفیل های قطعه بندی شده مشاهده شد.
مطالعات سمیت طولانی مدت انجام نشده است. مطالعات سمیت باروری در میمون های رزوس سمیت مادری و افزایش بروز سقط جنین خود به خود را نشان داده است. هیچ ناهنجاری در فرزندان زنده مشاهده نشد. هیچ مطالعه ای در مورد تأثیر بر باروری انجام نشده است. هیچ تاثیری بر چرخه فحلی میمون ها مشاهده نشد.
در یک مطالعه سمیت ژنتیکی جداگانه (آزمون ایمز)، هیچ اثر جهش زایی مشاهده نشد. مطالعات سرطان زایی انجام نشده است. آزمایش تبدیل سلولی در شرایط آزمایشگاهی هیچ پتانسیل سرطان زایی را نشان نداد.
فارماکوکینتیک. پس از تجویز زیر جلدی بتافرون در دوز توصیه شده 0.25 میلی گرم، غلظت سرمی اینترفرون بتا-1b پایین است یا اصلا قابل تشخیص نیست. در این رابطه اطلاعاتی در مورد فارماکوکینتیک دارو در بیماران مبتلا به مولتیپل اسکلروزیس دریافت کننده بتافرون در دوز توصیه شده وجود ندارد. پس از تجویز زیر جلدی 5/0 میلی گرم بتافرون، حداکثر غلظت پلاسمایی 1-8 ساعت پس از تزریق به دست می آید و حدود 40 واحد بین المللی در میلی لیتر است. فراهمی زیستی مطلق بتافرون در صورت تجویز زیر جلدی حدود 50 درصد است. هنگامی که اینترفرون بتا-1b به صورت داخل وریدی تجویز می شود، کلیرانس و نیمه عمر سرمی دارو به ترتیب 30 میلی لیتر در دقیقه بر کیلوگرم و 5 ساعت است.
تجویز بتافرون یک روز در میان منجر به افزایش غلظت اینترفرون بتا-lb در پلاسمای خون نمی شود و فارماکوکینتیک آن در طول دوره درمان تغییر نمی کند.
با استفاده زیر جلدی بتافرون با دوز 0.25 میلی گرم یک روز در میان، دستورالعمل استفاده: نشانگرهای پاسخ بیولوژیکی (نئوپترین، بتا2-میکروگلوبولین و سیتوکین سرکوب کننده ایمنی، اینترلوکین-10) نسبت به مقادیر پایه 6-12 ساعت پس از مصرف به طور قابل توجهی افزایش می یابد. اولین دوز دارو آنها در 40-124 ساعت به اوج خود رسیدند و در طول دوره مطالعه 7 روزه (168 ساعت) بالا باقی ماندند.
موارد مصرف بتافرون
سندرم بالینی ایزوله (CIS) (یک قسمت بالینی دمیلیناسیون که نشان دهنده مولتیپل اسکلروزیس است، مشروط به حذف تشخیص های جایگزین) با شدت کافی فرآیند التهابی برای تجویز کورتیکواستروئیدهای داخل وریدی برای کند کردن انتقال به مولتیپل اسکلروزیس قطعی بالینی (CDMS) در بیمارانی که در معرض خطر بالای ابتلا به KDRS هستند.
هیچ تعریف پذیرفته شده ای از ریسک بالا وجود ندارد. طبق این مطالعه، بیماران مبتلا به CIS مونوفوکال (تظاهرات بالینی 1 ضایعه در سیستم عصبی مرکزی) و بیش از 9 ضایعه T2 در MRI و/یا ضایعات تجمع کننده ماده حاجب در معرض خطر بالای ابتلا به CDRS در نظر گرفته می شوند. بیماران مبتلا به CIS چند کانونی (تظاهرات بالینی بیش از 1 ضایعه در سیستم عصبی مرکزی) بدون توجه به تعداد ضایعات در MRI در معرض خطر بالای ابتلا به CDRS هستند.
مولتیپل اسکلروزیس عودکننده-روکش کننده (RRMS) - برای کاهش فراوانی و شدت تشدید در بیماران سرپایی (یعنی بیمارانی که قادر به راه رفتن بدون کمک هستند) با سابقه حداقل 2 تشدید در 2 سال گذشته و به دنبال آن نقص کامل یا ناقص بهبودی عصبی .
مولتیپل اسکلروزیس پیشرونده ثانویه با یک دوره فعال بیماری که با تشدید یا بدتر شدن قابل توجه عملکردهای عصبی طی دو سال گذشته مشخص می شود - برای کاهش فراوانی و شدت تشدید بالینی بیماری و همچنین کاهش سرعت پیشرفت بیماری.
دستورالعمل استفاده و دوز
درمان با بتافرون باید زیر نظر یک پزشک با تجربه در درمان مولتیپل اسکلروزیس شروع شود. در حال حاضر، مسئله مدت زمان درمان با بتافرون حل نشده باقی مانده است. در مطالعات بالینی، طول مدت درمان در بیماران مبتلا به ام اس عود کننده- فروکش کننده و ثانویه پیشرونده به ترتیب به 5 و 3 سال رسید. مدت دوره توسط پزشک تعیین می شود.
تهیه محلول تزریقی
الف. بسته بندی محصول حاوی ویال و سرنگ های از پیش پر شده: برای حل کردن پودر لیوفیلیزه اینترفرون بتا-1b برای تزریق، از سرنگ از پیش پر شده همراه با حلال و سوزن عرضه شده استفاده کنید.
ب- بسته بندی محصول حاوی ویال، سرنگ های از پیش پر شده، آداپتور ویال سوزنی و دستمال مرطوب الکلی: برای حل کردن پودر لیوفیلیزه اینترفرون بتا-1b برای تزریق، از سرنگ آماده همراه با حلال و آداپتور ویال با سوزن استفاده کنید.
1.2 میلی لیتر حلال (محلول کلرید سدیم 0.54٪) با بتافرون وارد بطری می شود. پودر باید بدون تکان دادن کاملا حل شود. قبل از استفاده، باید محلول نهایی را بررسی کنید. در صورت وجود ذرات یا تغییر رنگ محلول، نباید از آن استفاده کرد. 1 میلی لیتر از محلول نهایی حاوی 0.25 میلی گرم (8 میلیون واحد بین المللی) اینترفرون بتا-lb است.
دوز توصیه شده بتافرون 0.25 میلی گرم (8 میلیون واحد بین المللی) است که در 1 میلی لیتر از محلول آماده شده وجود دارد و یک روز در میان به صورت زیر جلدی تجویز می شود. اگر فراموش کردید که تزریق را در زمان مقرر انجام دهید، باید به محض یادآوری دارو را به خود تزریق کنید. تزریق بعدی بعد از 48 ساعت انجام می شود.
ویژگی های برنامه
این دارو حاوی آلبومین انسانی است و به همین دلیل خطر انتقال بسیار پایین است بیماری های ویروسی. خطر تئوری انتقال بیماری کروتسفلد-جاکوب نیز بسیار بعید در نظر گرفته می شود.
تغییرات در پارامترهای آزمایشگاهی
علاوه بر آزمایشات آزمایشگاهی استاندارد تجویز شده برای مدیریت بیماران مبتلا به مولتیپل اسکلروزیس، قبل از شروع درمان با بتافرون، و همچنین به طور منظم در طول درمان، توصیه می شود یک آزمایش خون دقیق از جمله تعیین فرمول لکوسیت، تعداد پلاکت و تعیین فرمول لکوسیت ها انجام شود. تجزیه و تحلیل بیوشیمیاییخون، و همچنین عملکرد کبد را بررسی کنید (به عنوان مثال، فعالیت آسپارتات آمینوترانسفراز (AST)، آلانین آمینوترانسفراز (ALT) و گاما گلوتامیل ترانسفراز (g-GT)). هنگام مدیریت بیماران مبتلا به کم خونی، ترومبوسیتوپنی، لکوپنی (به صورت جداگانه یا ترکیبی)، ممکن است به نظارت دقیق تری بر شمارش کامل خون، از جمله تعیین تعداد گلبول های قرمز، گلبول های سفید، پلاکت ها و فرمول لکوسیتی نیاز باشد.
اختلالات دستگاه گوارش
در موارد نادر، در طول استفاده از Betaferon، ایجاد پانکراتیت مشاهده شد که در بیشتر موارد با وجود هیپرتری گلیسیریدمی همراه بود.
اختلال در عملکرد کبد و مجاری صفراوی
مطالعات بالینی نشان داده است که درمان با بتافرون اغلب می تواند منجر به افزایش بدون علامت در فعالیت ترانس آمینازهای "کبدی" شود که در بیشتر موارد خفیف و گذرا است. مانند سایر درمان های اینترفرون بتا، ضایعات شدیدکبد (از جمله نارسایی کبد) به ندرت هنگام استفاده از بتافرون مشاهده می شود. شدیدترین موارد در بیمارانی که در معرض داروها یا مواد سمی کبدی قرار گرفته اند و همچنین در برخی موارد مشاهده شده است. بیماری های همزمان(به عنوان مثال، نئوپلاسم های بدخیم با متاستاز، عفونت های شدیدو سپسیس، سوء مصرف الکل).
هنگام درمان با بتافرون، نظارت بر عملکرد کبد (از جمله ارزیابی) ضروری است تصویر بالینی). افزایش فعالیت ترانس آمیناز در سرم خون نیاز به نظارت و بررسی دقیق دارد. اگر افزایش قابل توجهی در فعالیت ترانس آمینازها در سرم خون وجود داشته باشد یا علائم آسیب کبدی (مثلاً زردی) ظاهر شود، دارو باید قطع شود. با غیبت علائم بالینیآسیب کبدی یا پس از عادی سازی فعالیت آنزیم های "کبدی"، می توان با نظارت بر عملکرد کبد، درمان با بتافرون را از سر گرفت.
اختلالات غدد درون ریز
به بیماران مبتلا به اختلال عملکرد تیروئید توصیه می شود که عملکرد تیروئید خود (هورمون های تیروئید، هورمون محرک تیروئید) را به طور منظم و در غیر این صورت طبق علائم بالینی بررسی کنند.
بیماری های سیستم قلبی عروقی
بتافرون باید با احتیاط در بیماران مبتلا به بیماری قلبی، به ویژه در مرحله نارسایی قلبی III-IV طبق طبقه بندی انجمن قلب نیویورک (NYHA) استفاده شود، زیرا چنین بیمارانی در مطالعات بالینی گنجانده نشده اند. اگر در طول درمان با بتافرون کاردیومیوپاتی ایجاد شود و اعتقاد بر این است که این امر با مصرف دارو همراه است، درمان با بتافرون باید قطع شود.
بیماری های سیستم عصبی
به بیماران باید اطلاع داده شود که عوارض جانبی بتافرون ممکن است شامل افسردگی و افکار خودکشی باشد و در صورت بروز، فوراً با پزشک مشورت کنند. در دو مطالعه بالینی کنترل شده شامل 1657 بیمار مبتلا به ام اس پیشرونده ثانویه، تفاوت معنی داری در بروز افسردگی و افکار خودکشی هنگام استفاده از بتافرون یا دارونما وجود نداشت. با این حال، هنگام تجویز بتافرون برای بیماران مبتلا به این بیماری باید احتیاط کرد اختلالات افسردگیو سابقه افکار خودکشی اگر چنین پدیدههایی در طول درمان رخ دهد، باید به سؤال در مورد توصیه قطع مصرف بتافرون توجه شود. بتافرون در بیماران با سابقه تشنج باید با احتیاط مصرف شود.
اختلالات عمومی و اختلالات محل تزریق
واکنش های آلرژیک جدی (نادر اما حاد و شدید، مانند برونکواسپاسم، آنافیلاکسی و کهیر) ممکن است رخ دهد. در صورت مشاهده علائم آسیب به یکپارچگی پوست (به عنوان مثال، نشت مایع از محل تزریق)، بیمار باید قبل از ادامه تزریق بتافرون با پزشک مشورت کند. مواردی از نکروز در محل تزریق در بیماران دریافت کننده بتافرون مشاهده شده است (به "عوارض جانبی" مراجعه کنید). نکروز می تواند گسترده باشد و به فاسیای عضلانی و همچنین بافت چربی گسترش یابد و در نتیجه منجر به تشکیل اسکار شود. در برخی موارد، برداشتن نواحی مرده یا کمتر رایج، پیوند پوست ضروری است. روند بهبودی می تواند تا 6 ماه طول بکشد.
اگر کانون های متعدد نکروز ظاهر شود، درمان با بتافرون باید تا بهبود کامل نواحی آسیب دیده متوقف شود. در صورت وجود یک کانون، اگر نکروز خیلی گسترده نباشد، می توان استفاده از بتافرون را ادامه داد، زیرا در برخی از بیماران بهبودی ناحیه مرده در محل تزریق در حین استفاده از بتافرون رخ داده است. به منظور کاهش خطر واکنش و نکروز در محل تزریق، به بیماران توصیه می شود:
- تزریق را کاملاً با رعایت قوانین آسپسیس انجام دهید.
- هر بار محل تزریق را تغییر دهید.
- دارو را کاملاً زیر جلدی تجویز کنید.
شما باید به طور دوره ای صحت خود تزریق را کنترل کنید، به خصوص اگر واکنش های موضعی رخ دهد.
آنتی بادی های خنثی کننده
مانند درمان با سایر داروهای حاوی پروتئین، هنگام استفاده از بتافرون امکان تشکیل آنتی بادی وجود دارد. در تعدادی از مطالعات بالینی کنترل شده، سرم خون هر 3 ماه یکبار برای تشخیص تشکیل آنتی بادی علیه بتافرون مورد تجزیه و تحلیل قرار گرفت. در این مطالعات نشان داده شد که آنتیبادیهای خنثیکننده به اینترفرون بتا-lb در ۲۳ تا ۴۱ درصد بیماران ایجاد شده است که حداقل دو نتیجه آزمایش مثبت بعدی تایید شد. در 55-43 درصد از این بیماران، متعاقب تحقیقات آزمایشگاهیعدم وجود پایدار آنتی بادی برای اینترفرون بتا-lb آشکار شد.
در مطالعه ای بر روی بیماران مبتلا به سندرم ایزوله بالینی که حاکی از مولتیپل اسکلروزیس است، فعالیت خنثی کننده، که هر 6 ماه یکبار اندازه گیری شد، در 16.5 تا 25.2 درصد از بیماران تحت درمان با بتافرون در ویزیت های مناسب مشاهده شد. فعالیت خنثی کننده حداقل یک بار در 30٪ (75) بیمارانی که بتافرون دریافت می کردند، شناسایی شد. 23% (17) از آنها قبل از اتمام مطالعه به وضعیت آنتی بادی منفی بازگشتند. در طول دوره مطالعه دو ساله، توسعه فعالیت خنثی کننده با کاهش اثربخشی بالینی (همانطور که با زمان تا مولتیپل اسکلروز قطعی بالینی اندازه گیری شد) همراه نبود.
وجود آنتی بادی های خنثی کننده هیچ اثر قابل توجهی بر نتایج بالینی نشان نداده است. توسعه فعالیت خنثی کننده با ظاهر هیچ کدام همراه نبود واکنش های نامطلوب. تصمیم برای ادامه یا قطع درمان باید بر اساس فعالیت بالینی بیماری باشد نه خنثی کردن وضعیت فعالیت.
اختلالات ایمنی
استفاده از سیتوکین ها در بیماران مبتلا به گاموپاتی مونوکلونال گاهی با افزایش سیستمیک در نفوذپذیری مویرگی همراه با ایجاد شوک و مرگ همراه بود.
در کودکان استفاده کنید
هیچ مطالعه سیستماتیکی در مورد اثربخشی و ایمنی بتافرون در کودکان و نوجوانان زیر 18 سال انجام نشده است.
تاثیر بر توانایی رانندگی ماشین و کار با ماشین آلات
مطالعات خاصی انجام نشده است. اثرات نامطلوب سیستم عصبی مرکزی ممکن است بر توانایی رانندگی ماشین و کار با ماشین آلات تأثیر بگذارد. در این رابطه، هنگام درگیر شدن در فعالیتهای بالقوه خطرناک که نیاز به توجه بیشتری دارند، باید احتیاط کرد.
اثرات جانبی
موارد زیر عوارض جانبی مشاهده شده با فراوانی 2% یا بیشتر از گروه دارونما (داروی غیرفعال) در بیمارانی است که در طی کارآزمایی های بالینی، بتافرون را با دوز 0.25 میلی گرم یا 0.16 میلی گرم در متر مربع یک روز در میان تا حداکثر دریافت کردند. سه سال . علائم آنفولانزا را می توان با استفاده از داروهای ضد التهابی غیر استروئیدی کاهش داد. تجربه استفاده از Betaferon برای درمان بیماران مبتلا به مولتیپل اسکلروزیس بسیار محدود است، بنابراین، واکنش های منفی که با فرکانس پایین رخ می دهد ممکن است هنوز مشاهده نشده باشد. مناسب ترین واژه فرهنگ لغت پزشکی برای فعالیت های تنظیمی (MedDRA) برای توصیف یک واکنش خاص، مترادف های آن و شرایط مرتبط استفاده می شود.
واکنش های عمومی: واکنش در محل تزریق، آستنی (ضعف)، مجموعه ای از علائم شبیه آنفولانزا، سردرد، تب، لرز، ادم محیطی، درد قفسه سینه، درد با نقاط مختلف، ضعف عمومی، نکروز در محل تزریق.
سیستم قلبی عروقی: افزایش یافته است فشار خون.
دستگاه گوارش: درد شکم.
خون و سیستم لنفاوی: لنفوسیتوپنی کمتر از 1500/mm3، نوتروپنی کمتر از 1500/mm3، لکوپنی کمتر از 3000/mm3. لنفادنوپاتی.
اختلالات متابولیک و تغذیه: افزایش فعالیت آنزیم های خون: آسپارتات آمینوترانسفراز (AST) 5 برابر مقدار اولیه، آلانین آمینوترانسفراز (ALT) 5 برابر مقدار اولیه.
سیستم اسکلتی عضلانی: میاستنی گراویس، میالژی، گرفتگی عضلات پا.
سیستم عصبی: بی خوابی، از دست دادن هماهنگی.
دستگاه تنفسی: تنگی نفس.
پوست: بثورات، ضایعات پوستی.
دستگاه تناسلی ادراری: میل ضروری به ادرار کردن، در زنان - متروراژی (بی چرخه) خونریزی رحم، در مردان - ناتوانی جنسی.
لیست پایین اثرات جانبیبر اساس مشاهدات پس از بازاریابی از مصرف بتافرون.
واکنش های عمومی: بسیار شایع: علائم شبه آنفولانزا (تب، لرز، میالژی، سردرد یا افزایش تعریق)*. فراوانی این علائم با گذشت زمان کاهش می یابد. به ندرت: ضعف عمومی، درد قفسه سینه، کاهش وزن، افزایش وزن.
واکنش های موضعی: اغلب: واکنش های محل تزریق (هیپرمی، ادم موضعی)، التهاب، درد. شایع: نکروز در محل تزریق. با گذشت زمان، با ادامه درمان، فرکانس واکنش ها در محل تزریق معمولا کاهش می یابد.
خون و سیستم لنفاوی: ناشایع: کم خونی، ترومبوسیتوپنی، لکوپنی. به ندرت: لنفادنوپاتی.
اختلالات غدد درون ریز: به ندرت: اختلال در عملکرد غده تیروئید، از جمله پرکاری تیروئید، کم کاری تیروئید.
اختلالات متابولیک: به ندرت: افزایش غلظت تری گلیسیرید.
سیستم عصبی: غیر معمول: هیپرتونیک عضلانی، افسردگی. به ندرت: تشنج، گیجی، بی قراری، ناتوانی عاطفی، اقدام به خودکشی، بی اشتهایی، سرگیجه.
سیستم قلبی عروقی: غیر معمول: افزایش فشار خون. به ندرت: کاردیومیوپاتی، تاکی کاردی، تپش قلب. بسیار نادر: اتساع عروق.
اندام های تنفسی: به ندرت: تنگی نفس، برونکواسپاسم.
دستگاه گوارش: ناشایع: تهوع و استفراغ. به ندرت: پانکراتیت، اسهال.
کبد و مجاری صفراوی: غیر معمول: افزایش فعالیت AST، ALT. به ندرت: افزایش فعالیت گاما گلوتامیل ترانسفراز، غلظت بیلی روبین، هپاتیت.
پوست و بافت زیر جلدی: غیر شایع: آلوپسی، کهیر، خارش پوست، بثورات پوستی. نادر: تغییر رنگ پوست.
ماهیچه های اسکلتی: غیر معمول: میالژی. به ندرت: آرترالژی.
دستگاه تناسلی زنان: به ندرت: بی نظمی قاعدگی. بسیار نادر: منوراژی (خونریزی طولانی مدت قاعدگی).
واکنش های آلرژیک: به ندرت: واکنش های آنافیلاکتیک.
تداخل با سایر داروها
مطالعات خاصی در مورد تداخل بتافرون با سایر داروها انجام نشده است. تأثیر مصرف بتافرون با دوز 0.25 میلی گرم (8 میلیون واحد بین المللی) یک روز در میان بر متابولیسم داروهادر بیماران مبتلا به مولتیپل اسکلروزیس ناشناخته است. با استفاده از بتافرون، گلوکوکورتیکواستروئیدها و ACTH که تا 28 روز در درمان تشدید تجویز می شوند، به خوبی تحمل می شوند. استفاده همزمان از بتافرون با تعدیل کننده های ایمنی غیر از کورتیکواستروئیدها یا ACTH مورد مطالعه قرار نگرفته است. اینترفرون ها فعالیت آنزیم های وابسته به سیتوکروم P450 کبدی را در انسان ها و حیوانات کاهش می دهند. داروهای ضد صرع، داروهای ضد افسردگی). همچنین هنگام استفاده همزمان از هر دارویی که بر سیستم خونساز تأثیر می گذارد، باید احتیاط کرد. به دلیل عدم انجام مطالعات سازگاری، این فرآورده دارویی نباید با سایر فرآورده های دارویی مخلوط شود.
موارد منع مصرف
- بارداری.
- شیردهی.
- سابقه واکنش های حساسیت به اینترفرون بتا طبیعی یا نوترکیب یا آلبومین انسانی.
بتافرون در بیماران مبتلا به بیماری های زیر باید با احتیاط مصرف شود:
- بیماری قلبی، به ویژه، نارسایی قلبی مرحله III-IV طبق طبقه بندی انجمن قلب نیویورک (NYHA)، کاردیومیوپاتی.
- افسردگی و افکار خودکشی (از جمله سابقه)، سابقه حملات صرع؛
- گاموپاتی مونوکلونال؛
- کم خونی، ترومبوسیتوپنی، لکوپنی؛
- اختلال عملکرد کبد
به دلیل عدم تجربه کافی در مصرف، هنگام استفاده در بیماران زیر 18 سال احتیاط لازم است.
بارداری. ناشناخته است که آیا بتافرون می تواند هنگام درمان در زنان باردار باعث آسیب به جنین شود یا بر عملکرد تولید مثل انسان تأثیر بگذارد. در مطالعات بالینی کنترل شده، مواردی از سقط جنین خود به خود در بیماران مبتلا به مولتیپل اسکلروزیس گزارش شده است. در مطالعات روی میمونهای رزوس، اینترفرون بتا-^ انسانی اثر جنینی و بیشتر داشت دوزهای بالاباعث افزایش دفعات سقط جنین شد. زنان در سنین باروری هنگام درمان با این دارو باید از روش های قابل اعتماد پیشگیری از بارداری استفاده کنند. اگر بارداری در طول درمان با بتافرون رخ دهد یا بارداری برنامه ریزی شده باشد، توصیه می شود دارو را قطع کنید.
شیردهی. مشخص نیست که آیا اینترفرون بتا-1b در شیر مادر ترشح می شود یا خیر. با توجه به احتمال تئوری بروز عوارض جانبی به بتافرون در شیرخوارانی که با شیر مادر تغذیه می شوند، قطع شیردهی یا قطع دارو ضروری است.
در دوران بارداری منع مصرف دارد (ممکن است باعث مرگ جنین یا ایجاد ناهنجاری های مادرزادی شود). شیردهی باید در طول درمان قطع شود.
مصرف بیش از حد
هنگامی که Betaferon به صورت داخل وریدی با دوز حداکثر 5.5 میلی گرم (176 میلیون واحد بین المللی) سه بار در هفته برای بیماران بزرگسال مبتلا به سرطان تجویز شد، هیچ عارضه جانبی جدی شناسایی نشد.
