Betaferon: návod na použitie a recenzie
latinský názov: Betaferon
ATX kód: L03AB08
Účinná látka: Interferón beta-1b (interferón beta-1b)
Výrobca: Boehringer Ingelheim Pharma (Nemecko)
Popis a aktualizácia fotiek: 06.08.2019
Betaferon je imunomodulačný liek používaný na liečbu roztrúsenej sklerózy.
Forma a zloženie uvoľnenia
Lieková forma - lyofilizát na prípravu roztoku na subkutánna injekcia: lyofilizovaná biela hmota (v sklenených fľašiach s rozpúšťadlom (v injekčnej striekačke), v plastových paletách, 5 alebo 15 paliet v kartónovej krabici).
V 1 fľaštičke:
- Účinná látka: rekombinantný interferón beta-1b - 9,6 miliónov IU (0,3 mg);
- Pomocné látky: ľudský albumín, manitol.
Rozpúšťadlo: roztok chloridu sodného 0,54 % (sterilný).
Farmakodynamika a farmakokinetika
Interferón beta-lb, ktorý je súčasťou lieku, má imunomodulačnú a antivírusovú aktivitu.
Mechanizmus účinku tejto látky pri roztrúsenej skleróze nebol definitívne stanovený, je však známe, že použitie Betaferonu pri relapsujúcej a sekundárne progresívnej roztrúsenej skleróze môže znížiť frekvenciu (o 30 %) a závažnosť klinických exacerbácií ochorenia , potreba liečby glukokortikosteroidmi, ako aj zníženie počtu hospitalizácií a predĺženie trvania remisie.
Pri liečbe Betaferonom u pacientov so sekundárne progresívnou roztrúsenou sklerózou došlo k oneskoreniu ďalšej progresie ochorenia a nástupu postihnutia (vrátane ťažkého, pri ktorom pacienti musia neustále používať invalidný vozík) až o 12 mesiacov. Podobný účinok sa vyskytuje u pacientov s exacerbáciami ochorenia alebo bez nich, ako aj s akýmkoľvek indexom invalidity (štúdia sa uskutočnila za účasti pacientov so skóre 3–6,5 bodu).
Výsledky MRI mozgu pacientov so sekundárne progresívnou a recidivujúcou sklerózou multiplex potvrdzujú skutočnosť, že liečba liekom má pozitívny vplyv na závažnosť patologický proces a výrazne znižuje riziko nových aktívnych lézií.
Štúdie akútnej toxicity sa neuskutočnili. Štúdie toxicity po opakovanom podávaní u opíc rhesus naznačujú možnosť vzniku prechodnej hypertermie, ktorá je sprevádzaná výrazným prechodným znížením počtu segmentovaných neutrofilov a krvných doštičiek a prechodným zvýšením koncentrácie lymfocytov.
Štúdie reprodukčnej toxicity vykonané na opiciach rhesus ukázali, že Betaferon nie je toxický len pre matku, ale zvyšuje aj výskyt spontánnych potratov. Zároveň neboli pozorované žiadne malformácie u žijúcich potomkov.
Štúdie účinku lieku na plodnosť sa neuskutočnili, nebol zaznamenaný žiadny vplyv na estrálny cyklus opíc.
Jedna jediná štúdia genotoxicity (Amesov test) nedokázala odhaliť žiadne mutagénne účinky.
Neuskutočnili sa ani štúdie karcinogenity a výsledky testu bunkovej transformácie in vitro nepreukázali prítomnosť žiadneho karcinogénneho potenciálu.
Pri subkutánnom podaní odporúčaných dávok Betaferonu (0,25 mg) sú sérové koncentrácie interferónu beta-lb nízke alebo sa vôbec nezistili. Preto neexistujú žiadne údaje o farmakokinetike lieku u pacientov so sklerózou multiplex, ktorí dostávajú odporúčané dávky lieku.
Pri subkutánnej dávke 0,5 mg sa maximálna plazmatická koncentrácia pozoruje 1-8 hodín po injekcii a je približne 40 IU / ml. Absolútna biologická dostupnosť liečiva pri subkutánnom podaní je približne 50 %.
o intravenózne podanie klírens a polčas Betaferonu zo séra sú 30 ml/min/kg a 5 hodín.
Injekcie Betaferonu každý druhý deň nespôsobujú zvýšenie koncentrácie interferónu beta-lb v krvnej plazme a farmakokinetika lieku sa počas celej liečby nemení.
Subkutánne podávanie lieku každý druhý deň v dávke 0,25 mg vedie k významnému zvýšeniu obsahu markerov biologickej odpovede (interleukín-10, neopterín, imunosupresívny cytokín, beta2-mikroglobulín) v porovnaní s východiskovými hodnotami 6–12 hodín po prvej dávke lieku. Tento indikátor dosiahol svoj vrchol po 40–124 hodinách a zostal zvýšený počas celého obdobia štúdie (7 dní alebo 168 hodín).
Indikácie na použitie
- Klinicky izolovaný syndróm (jediná klinická epizóda demyelinizácie, ktorá umožňuje, s výnimkou alternatívnych diagnóz, navrhnúť sklerózu multiplex);
- Sekundárne progresívna roztrúsená skleróza s aktívnym priebehom ochorenia vrátane exacerbácií alebo výrazného zhoršenia neurologických funkcií za posledných niekoľko rokov (použitie Betaferonu môže znížiť frekvenciu a závažnosť takýchto exacerbácií, ako aj spomaliť rýchlosť progresie choroby);
- Recidivujúca-remitujúca skleróza multiplex. Liek je účinný pri znižovaní frekvencie a závažnosti exacerbácií ochorenia u ambulantných pacientov (schopných pohybu bez pomoci) s anamnézou najmenej dvoch exacerbácií ochorenia za posledné dva roky, po ktorých nasleduje uzdravenie (úplné alebo neúplné) neurologické symptómy.
Kontraindikácie
Použitie lieku je kontraindikované počas tehotenstva, laktácie, precitlivenosti na zložky lieku.
Opatrnosť si vyžaduje vymenovanie lieku pacientom so srdcovým ochorením, ako aj trombocytopéniou, anémiou, poruchou funkcie pečene, depresiou a samovražednými myšlienkami v anamnéze.
Skúsenosti s použitím Betaferonu u detí sú obmedzené.
Návod na použitie Betaferonu: spôsob a dávkovanie
Liečba sa má začať pod dohľadom skúseného lekára.
Vedľajšie účinky
Pri používaní Betaferonu rôzne vedľajšie účinky. Na časti tela ako celku sa zvyčajne prejavujú ako asténia, celková nevoľnosť, reakcia v mieste vpichu, bolesť hlavy, bolesť na hrudníku, horúčka, zimnica, bolesť brucha, bolesť odlišná lokalizácia, nekróza v mieste vpichu, komplex symptómov podobných chrípke, s rozvojom ktorých môže lekár predpísať nesteroidné protizápalové lieky.
Liek môže spôsobiť niektoré dermatologické reakcie, ktoré sa zvyčajne prejavujú ako vyrážka a kožné lézie.
Okrem toho sa počas liečby Betaferonom môžu s rôznou frekvenciou vyskytnúť poruchy kardiovaskulárneho, muskuloskeletálneho, nervového, tráviaceho, močového, dýchacieho a reprodukčného systému tela.
Predávkovanie
Po zavedení Betaferonu v dávke 5,5 mg 3-krát týždenne sa u dospelých pacientov s onkologické ochorenia neboli dodržané.
špeciálne pokyny
Betaferon obsahuje ľudský albumín, takže riziko prenosu vírusových ochorení je veľmi malé.
Pacienti počas inej ako štandardnej liečby laboratórne testy odporúča sa pravidelne vykonávať podrobný krvný test. Pacienti s anémiou, leukopéniou a trombocytopéniou môžu tiež vyžadovať starostlivejšie sledovanie kompletného krvného obrazu vrátane stanovenia počtu leukocytov, erytrocytov, krvných doštičiek a leukocytový vzorec.
V 1 fľaštičke interferón beta-1b - 0,30 mg (alebo 9,6 milióna IU). Ľudský albumín a manitol - ako pomocné látky.
Formulár na uvoľnenie
Lyofilizát na prípravu roztoku alebo suspenzie 9,6 milióna IU v injekčnej liekovke.
farmakologický účinok
Imunomodulačný.
Farmakodynamika a farmakokinetika
Farmakodynamika
Účinná látka interferón beta-1b má antivírusové a imunomodulačné účinky. Mechanizmus jeho účinku nebol definitívne stanovený, ale je známe, že je spojený s interakciami s určitými receptormi. Väzba na tieto receptory vyvoláva expresiu látok, ktoré boli zistené v krvi pacientov liečených týmto liekom. beta interferón zvyšuje supresívny účinok mononukleárnych krviniek.
U pacientov so sekundárne progresívnou formou RS užívanie lieku odďaľuje progresiu ochorenia a invaliditu až o jeden rok. výsledky MRI mozgu pacientov potvrdzujú pozitívnu dynamiku: pokles tvorby nových ložísk. Štúdia toxicity a karcinogenity lieku sa neuskutočnila. Uskutočnil sa test bunkovej transformácie in vitro nevykazoval žiadnu karcinogénnu aktivitu.
Farmakokinetika
Pri subkutánnom podaní v dávke 1 ml (0,25 mg) koncentrácie interferón beta v krvi sú nízke alebo sa nezistili, takže neexistujú žiadne informácie o farmakokinetike. Po zavedení 0,5 mg sa maximálna koncentrácia stanoví po 1-8 hodinách. Biologická dostupnosť 50 %. Ak bol liek podaný intravenózne, jeho polčas je 5 hodín.
Subkutánne podávanie každý druhý deň nespôsobuje zvýšenie koncentrácie v krvi. o subkutánna aplikácia každý druhý deň pri dávke 0,25 mg sa indikátory markerov biologickej odpovede významne zvyšujú 6-12 hodín po prvej dávke, dosahujú vrchol po 40-125 hodinách a zostávajú zvýšené 168 hodín.
Indikácie na použitie
- izolovaný syndróm s výrazným zápalovým procesom, pri ktorom existujú indikácie na použitie intravenózne kortikosteroidy , s cieľom spomaliť prechod na spoľahlivé RS . Zvyčajne ide o pacientov s klinické prejavy viac ako jedno ohnisko CNS ;
- relaps-remitujúca SM (s cieľom znížiť frekvenciu exacerbácií v prítomnosti 2 alebo viacerých exacerbácií za 2 roky s neúplným zotavením neurologického stavu);
- sekundárne progresívna MS , ktorá má aktívny priebeh s exacerbáciami počas 2 rokov a výrazným zhoršením neurologického stavu (s cieľom znížiť frekvenciu exacerbácií a spomaliť progresiu).
Kontraindikácie
- precitlivenosť;
- laktácie.
Používa sa opatrne, keď zástava srdca III-IV etapy, anémia , leukopénia a zhoršená funkcia pečene.
Vedľajšie účinky
Časté reakcie:
- reakcie v mieste vpichu (bolesť, hyperémia , zápal, );
- príznaky podobné chrípke (zimnica, myalgia ).
Zriedkavé reakcie:
- nevoľnosť, bolesť na hrudníku;
- anémia , leukopénia ;
- chudnutie alebo prírastok hmotnosti;
- alebo ;
- hypertonicita svaly;
- kŕče , agitovanosť, pokusy o samovraždu, emočná labilita;
- , zosilnenie ;
- A bronchospazmus ;
- myalgia A artralgia ;
- nevoľnosť, vracanie;
- anafylaktické reakcie;
- , svrbenie, vyrážka;
- priestupkov menštruačný cyklus.
Veľmi zriedkavé reakcie:
- vazodilatácia ;
- menorágia .
Betaferon, návod na použitie (metóda a dávkovanie)
Liečivo sa podáva subkutánne. Na rozpustenie prášku interferón beta Do injekčnej liekovky sa vstrekne 1,2 ml rozpúšťadla. Prášok sa dobre rozpúšťa bez pretrepávania. Ak sú v ňom nerozpustené častice, roztok nemožno použiť.
Betaferon at roztrúsená skleróza podávaný každý druhý deň, 1 ml roztoku (0,25 mg interferón beta ). V prípade vynechania injekcie sa vykoná okamžite a ďalšia sa vyrobí tak, ako má byť, po 48 hodinách. Dĺžku kurzu určuje lekár, v klinických štúdiách dosiahla 3 až 5 rokov.
Predávkovanie
Dokonca aj po zavedení lieku intravenózne v dávke 5,5 mg trikrát sa nevyskytli žiadne významné nežiaduce reakcie.
Interakcia
Interakčné štúdie s inými liekmi sa neuskutočnili. Glukokortikosteroidy používané súčasne na exacerbácie sú dobre tolerované. Užívanie Betaferonu s inými imunomodulátory nebol skúmaný. Buďte opatrní pri predpisovaní v spojení s liekmi, ktorých klírens závisí od systému cytochróm P450 (antidepresíva, antiepileptiká), ako aj lieky ovplyvňujúce krvotvorbu. Nemiešajte s liekmi v tej istej injekčnej striekačke.
Podmienky predaja
Na predpis.
Podmienky skladovania
Teplota do 25°С.
Dátum minimálnej trvanlivosti
Analógy Betaferonu
Zhoda v kóde ATX 4. úrovne:infibeta , Ronbetal , Extavia .
Catad_pgroup Lieky na sklerózu multiplex
Betaferon - návod na použitie
EVIDENČNÉ ČÍSLO:
OBCHODNÝ NÁZOV DROGY:
Betaferon
MEDZINÁRODNÝ NECHRÁNENÝ NÁZOV:
Interferón beta-1b
LIEKOVÁ FORMA:
Lyofilizát na prípravu roztoku na subkutánne podanie
COMPOUND
Každá fľaša s účinnou látkou obsahuje: Interferón beta-1b (IFN-beta-1b) - 0,30 mg (zodpovedá 9,6 milióna IU), ľudský albumín - 15,00 mg, manitol - 15,00 mg.
1 ml pripraveného roztoku obsahuje 0,25 mg (8,0 miliónov IU) rekombinantného interferónu beta-1b.
1 ml vodného rozpúšťadla na injekčný roztok obsahuje 5,4 mg chloridu sodného.
POPIS
Lyofilizát: Lyofilizovaná hmota bielej farby.
Solventný: Číry, takmer bezfarebný roztok.
Rekonštituovaný roztok: Mierne opaleskujúci až opaleskujúci roztok, bezfarebný príp svetlo žltá.
FARMAKOTERAPEUTICKÁ SKUPINA
Cytokín. Prostriedky na liečbu roztrúsenej sklerózy.
ATH KÓD: L03AB08
FARMAKOLOGICKÉ VLASTNOSTI
Farmakodynamika
Interferóny sú proteíny patriace do rodiny cytokínov s molekulovou hmotnosťou 15 000 až 21 000 daltonov. Existujú tri triedy interferónov: interferón alfa, interferón beta a interferón gama, ktoré majú odlišné, ale prekrývajúce sa biologické aktivity. Aktivita interferónu beta-1b je druhovo špecifická, takže najvýznamnejšie farmakologické informácie o interferóne beta-1b možno získať zo štúdií s kultivovanými ľudské bunky alebo v štúdiách in vivo na ľuďoch.
Účinná látka lieku Betaferon (interferón beta-1b) má antivírusovú a imunomodulačnú aktivitu. Mechanizmy účinku interferónu beta-1b pri roztrúsenej skleróze (MS) neboli úplne stanovené. Je však známe, že biologický účinok interferónu beta-1b je sprostredkovaný jeho interakciou so špecifickými receptormi nachádzajúcimi sa na povrchu ľudských buniek. Väzba interferónu beta-1b na tieto receptory indukuje expresiu mnohých látok, ktoré sa považujú za mediátory biologických účinkov interferónu beta-1b. Obsah niektorých z týchto látok bol stanovený v sére a vo frakciách krvných buniek pacientov liečených interferónom beta-1b. Interferón beta-1b znižuje väzbovú kapacitu a tiež zvyšuje internalizáciu a degradáciu receptorov pre gama-interferón. Okrem toho interferón beta-1b zvyšuje supresorovú aktivitu mononukleárnych buniek periférnej krvi. Samostatné štúdie o účinku Betaferonu na kardiovaskulárne, respiračné a endokrinný systém neboli vykonané.
Klinické výskumy:
Recidivujúca-remitujúca skleróza multiplex
V klinickej štúdii u pacientov s relaps-remitujúcou roztrúsenou sklerózou, ktorí boli schopní chodiť bez pomoci ( základná hodnota EDSS od 0 do 5,5), ukázalo sa, že liečba Betaferonom znižuje frekvenciu (o 30 %) a závažnosť klinických exacerbácií ochorenia, počet hospitalizácií v dôsledku ochorenia a tiež predlžuje trvanie remisie. Informácie o účinku liečby Betaferonom na trvanie relapsu alebo nástup symptómov medzi exacerbáciami, ako aj na progresiu ochorenia pri relaps-remitujúcej skleróze multiplex nie sú dostupné.
Sekundárne progresívna roztrúsená skleróza:
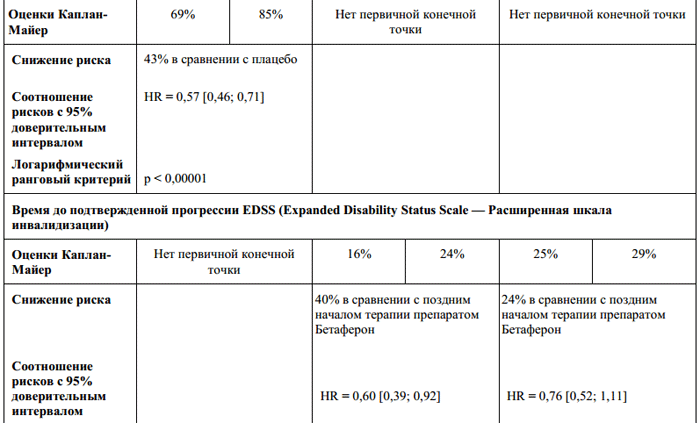
Uskutočnili sa dve kontrolované klinické štúdie u 1657 pacientov so sekundárne progresívnou SM (východisková hodnota EDSS 3 až 6,5, t.j. pacienti schopní chodiť). Pacienti s mierny stupeň choroby, ako aj pacienti neschopní pohybu, neboli do štúdií zaradení. Výsledky oboch štúdií ukázali protichodné výsledky pre primárny koncový ukazovateľ, čas do potvrdenej progresie ochorenia, oddialenie progresie invalidity.
V jednej z dvoch štúdií sa počas liečby Betaferonom preukázalo štatisticky významné oneskorenie v progresii invalidity (pomer rizika = 0,69, 95 % interval spoľahlivosti(0,55; 0,86), p=0,0010 zodpovedá 31 % zníženiu rizika v dôsledku liečby Betaferonom) a ťažkému postihnutiu (t. j. keď sú pacienti nútení neustále používať invalidný vozík) (pomer rizika = 0,61, 95 % interval spoľahlivosti ( 0,44; 0,85), p=0,0036 zodpovedá 39 % zníženiu rizika v dôsledku liečby Betaferonom). Tento účinok bol pozorovaný počas 33 mesiacov u pacientov s akýmkoľvek indexom invalidity, bez ohľadu na frekvenciu relapsov. V druhej štúdii zahŕňajúcej pacientov so sekundárne progresívnou SM nedošlo k oneskoreniu nástupu invalidity v dôsledku liečby Betaferonom. Existujú dôkazy, že pacienti sa zapísali do táto štúdia, boli v menej aktívnom štádiu ochorenia v porovnaní s pacientmi, ktorí sa zúčastnili prvej štúdie.
Údaje z retrospektívnej metaanalýzy oboch štúdií ukázali celkový štatisticky významný účinok liečby (p = 0,0076; 8 miliónov IU Betaferonu v porovnaní s pacientmi, ktorí dostávali placebo).
Retrospektívna analýza podskupiny ukázala, že liečba Betaferonom mala pravdepodobnejší vplyv na čas do nástupu postihnutia u pacientov s aktívnym ochorením pred liečbou (pomer rizika 0,72, 95 % interval spoľahlivosti (0,59; 0,88), p= 0,0011 zodpovedá 28 % zníženiu rizika v dôsledku liečby Betaferonom u pacientov s relapsmi alebo závažnou progresiou EDSS, 8 miliónov IU Betaferonu v porovnaní s pacientmi liečenými placebom). Retrospektívne údaje naznačujú, že relapsy, ako aj výrazná progresia EDSS (EDSS >1 alebo EDSS >0,5 pre EDSS >6 v predchádzajúcich dvoch rokoch) môžu pomôcť identifikovať pacientov s aktívnym ochorením.
V oboch štúdiách u pacientov so sekundárne progresívnou roztrúsenou sklerózou znížila liečba Betaferonom frekvenciu klinických exacerbácií o 30 %. Neexistujú žiadne údaje o účinku liečby na trvanie relapsov.
Klinicky izolovaný syndróm naznačujúci roztrúsenú sklerózu
Jedna kontrolovaná klinická štúdia bola vykonaná u pacientov s klinicky izolovaným syndrómom a nálezmi pri zobrazovaní magnetickou rezonanciou mozgu (MRI), ktoré naznačujú roztrúsenú sklerózu (najmenej dve lézie nie sú klinicky zjavné na T2 vážených snímkach MRI). Do štúdie boli zaradení pacienti s monofokálnym alebo multifokálnym začiatkom ochorenia (t. j. pacienti s klinickými prejavmi jednej alebo aspoň dvoch lézií centrálnej nervový systém). Zo štúdie boli vylúčení pacienti so symptómami akéhokoľvek ochorenia podobnými symptómom roztrúsenej sklerózy.
Táto štúdia zahŕňala 2 fázy: placebom kontrolovanú fázu (placebo verzus Betaferon), po ktorej nasledovala vopred plánovaná fáza sledovania. Fáza kontrolovaná placebom trvala 2 roky alebo do rozvoja klinicky významnej sklerózy multiplex (MSMS), podľa toho, čo nastalo skôr. Po dokončení placebom kontrolovanej fázy štúdie pacienti vstúpili do vopred plánovanej fázy sledovania, aby sa porovnali účinky skorého a neskorého začatia liečby Betaferonom. Uskutočnili sa porovnania medzi pacientmi pôvodne randomizovanými na Betaferon (skupina s betaferonom na začiatku liečby) a placebom (skupina s neskorým začatím liečby).
Stôl 1.
RVýsledky primárnej účinnosti založené na údajoch zo štúdie BENEFIT a výsledky sledovania podľa štúdieBENEFIT Sledujte- hore.

V placebom kontrolovanej fáze štúdie Betaferon spomalil progresiu ochorenia od prvého klinického prejavu ku klinicky významnej skleróze multiplex. Liečba Betaferonom spôsobila stabilné oneskorenie progresie roztrúsenej sklerózy podľa McDonaldových kritérií (tabuľka 1).
Liečba Betaferonom mala vplyv na progresiu ochorenia do CRMS vo všetkých analyzovaných podskupinách. Pacienti s monoléznou formou a najmenej deviatimi léziami na T2 vážených obrázkoch alebo Gd-enhancement na základnej línii MRI mozgu mali zvýšené riziko progresie ochorenia do CRMS do 2 rokov. U pacientov s multifokálnou formou načasovanie vývoja ochorenia pred CRMS nezáviselo od počiatočných parametrov MRI, ktoré vychádza z
klinické pozorovania naznačili vysoké riziko CRMS v dôsledkuprogresie ochorenia. Zapnuté tento moment neexistuje jasná definícia
definícia pojmu „vysoké riziko“. Konzervatívnejším prístupom by bola identifikácia aspoň deviatich hyperintenzívnych lézií na T2-vážených obrázkoch pri počiatočnom skenovaní a aspoň jednej novej lézie na T2-vážených obrázkoch alebo jednej novej Gd-enhancovanej lézie aspoň jeden mesiac po počiatočnom skenovaní. . V každom prípade by sa liečba mala podávať len vysokorizikovým pacientom.
Vysoké percento pacientov, ktorí dokončili štúdiu (93 % v skupine s Betaferonom), naznačilo, že liečba Betaferonom bola dobre tolerovaná. Na zvýšenie znášanlivosti lieku na začiatku terapie sa vykonala titrácia dávky a zavedenie nesteroidných protizápalových liekov. Navyše, počas celej štúdie sa väčšine pacientov podával liek pomocou autoinjektora.
V následnej fáze otvoreného pozorovania bol efekt terapie po 3 a 5 rokoch liečby evidentný (tabuľka 1), aj keď väčšina pacientov v skupine s placebom dostávala liečbu Betaferonom minimálne od druhého roku ochorenia. V skupine s včasnou liečbou Betaferonom (tabuľka 1, výrazný účinok po 3 rokoch, žiadny významný účinok po 5 rokoch) bola progresia ochorenia na stupnici EDSS (potvrdené zvýšenie EDSS aspoň o jeden bod v porovnaní s východiskovou hodnotou) nižšia. Väčšina pacientov v oboch skupinách nezaznamenala progresiu invalidity do 5 rokov. Pre „včasné začatie liečby“ sa nepreukázal žiadny trvalý účinok na túto základnú líniu. Nezistili sa žiadne prínosy z hľadiska kvality života stanovenej v súlade s FAMS (Functional Assessment of MS – funkčné hodnotenie roztrúsenej sklerózy: index liečby, výsledok) z dôvodu včasného začatia liečby Betaferonom.
Recidivujúca-remitujúca roztrúsená skleróza, sekundárne progresívna roztrúsená skleróza a klinicky izolovaný syndróm naznačujúci roztrúsenú sklerózu.
Výsledky MRI u pacientov so sklerózou multiplex preukázali účinnosť lieku Betaferon a spomalenie priebehu ochorenia vo všetkých štúdiách. Podľa výsledkov hodnotenia MRI zatiaľ nie je objasnený vzťah medzi priebehom sklerózy multiplex a klinickým výsledkom.
Toxikologická charakterizácia
Štúdie akútnej toxicity sa neuskutočnili. Keďže hlodavce nie sú citlivé na účinky ľudského interferónu beta, hodnotenie rizika bolo založené na štúdiách toxicity po opakovanom podávaní u opíc rhesus. Pozorovala sa prechodná hypertermia spolu s výrazným prechodným zvýšením koncentrácie lymfocytov a prechodným znížením počtu krvných doštičiek a segmentovaných neutrofilov.
Dlhodobé štúdie toxicity sa neuskutočnili. Štúdie reprodukčnej toxicity u opíc rhesus preukázali materskú toxicitu a zvýšenie miery spontánnych potratov. U živých potomkov neboli pozorované žiadne malformácie. Štúdie účinku na fertilitu sa neuskutočnili. Nebol pozorovaný žiadny vplyv na estrálny cyklus opíc.
V jednom samostatné štúdium genotoxicity (Amesov test), neboli pozorované žiadne mutagénne účinky. Štúdie karcinogenity sa neuskutočnili. Test bunkovej transformácie in vitro neodhalil žiadny karcinogénny potenciál.
Farmakokinetika
Plazmatická koncentrácia interferónu beta-1b u pacientov a dobrovoľníkov bola stanovená pomocou špecifického biologického testu.
Po subkutánnej injekcii 0,5 mg (16,0 miliónov IU) interferónu beta-1b sa maximálna plazmatická koncentrácia dosiahne 1-8 hodín po injekcii a je približne 40 IU/ml. Podľa rôznych štúdií je pri intravenóznom podaní interferónu beta-1b priemerný klírens a jeho polčas z plazmy 30 ml/min/kg, respektíve 5 hodín.
Zavedenie lieku Betaferon každý druhý deň nevedie k zvýšeniu koncentrácie interferónu beta-1b v krvnej plazme a jeho farmakokinetika sa v priebehu liečby nemení.
Pri subkutánnom podaní interferónu beta-1b je absolútna biologická dostupnosť približne 50 %.
INDIKÁCIE NA POUŽITIE
Klinicky izolovaný syndróm (CIS) (jediná klinická epizóda demyelinizácie naznačujúca roztrúsenú sklerózu, s výnimkou alternatívnych diagnóz) s dostatočnou závažnosťou zápalový proces na podávanie intravenóznych kortikosteroidov
spomalenie prechodu na klinicky významnú sklerózu multiplex (CRMS) u pacientov s vysokým rizikom vzniku CRMS.
Neexistuje všeobecne akceptovaná definícia vysokého rizika. Podľa štúdie pacienti s monofokálnym CIS (klinické prejavy 1 lézie v CNS) a ≥ 9 ložiskami na T2 vážených snímkach na MRI a/alebo kumulatívnom kontrastná látka ohniská. Pacienti s multifokálnym CIS (klinické prejavy >1 lézie v CNS) majú vysoké riziko vzniku CRMS bez ohľadu na počet ložísk na MRI.
Relaps-remitujúca roztrúsená skleróza (RRMS) – na zníženie frekvencie a závažnosti exacerbácií u ambulantných pacientov (t. j. pacientov schopných chodiť bez pomoci) s anamnézou najmenej 2 exacerbácií za posledné dva roky, po ktorých nasleduje úplná alebo neúplná obnova neurologický deficit.
Sekundárne progresívna roztrúsená skleróza s aktívnym priebehom ochorenia, charakterizovaná exacerbáciami alebo výrazným zhoršením neurologických funkcií za posledné dva roky - na zníženie frekvencie a závažnosti klinických exacerbácií ochorenia, ako aj na spomalenie rýchlosti progresie choroby.
KONTRAINDIKÁCIE
- Tehotenstvo.
- Dojčenie.
- Reakcie z precitlivenosti na prirodzený alebo rekombinantný interferón beta v anamnéze a zložky, ktoré tvoria liek.
- Ťažká depresia a/alebo samovražedné myšlienky.
- Choroby pečene v štádiu dekompenzácie.
- Detstvo do 18 rokov (informácie o účinnosti a bezpečnosti používania interferónu beta-1b u detí sú obmedzené).
POZORNE
Betaferon sa má používať opatrne u pacientov s nasledujúcimi ochoreniami:
- srdcové choroby, najmä srdcové zlyhanie III-IV funkčná trieda podľa klasifikácie New York Heart Association (NYHA), kardiomyopatia;
- epileptické záchvaty v histórii;
- monoklonálna gamapatia;
- anémia, trombocytopénia, leukopénia;
- závažné zlyhanie obličiek.
POUŽÍVANIE V TEHOTENSTVE A POČAS DOJČENIA
Tehotenstvo
K dispozícii sú obmedzené informácie o potenciáli Betaferonu spôsobiť poškodenie plodu počas liečby u tehotných žien alebo ovplyvniť reprodukčnú funkciu človeka. V kontrolovaných klinických štúdiách u pacientov so sklerózou multiplex sa vyskytli prípady spontánneho potratu. Použitie lieku Betaferon počas tehotenstva je kontraindikované.
Ženy v reprodukčnom veku majú počas liečby Betaferonom používať spoľahlivé metódy antikoncepcie. V prípade otehotnenia počas liečby alebo pri plánovaní tehotenstva má byť pacientka informovaná o možnom riziku pre plod. V tomto prípade sa odporúča prerušiť používanie Betaferonu.
U pacientok s vysokou mierou relapsov v anamnéze je pred začatím liečby potrebné vyhodnotiť riziko vzniku závažného relapsu po ukončení liečby liekom počas gravidity oproti možnému riziku spontánneho potratu.
obdobie dojčenia
Nie je známe, či sa interferón beta-1b vylučuje materské mlieko. Berúc do úvahy teoretickú možnosť vzniku nežiaducich reakcií na liek Betaferon u dojčiat, ktoré sú na dojčenie, je potrebné ukončiť dojčenie alebo vysadiť liek.
SPÔSOB APLIKÁCIE A DÁVKOVANIE
Liečba Betaferonom sa má začať pod dohľadom lekára, ktorý má skúsenosti s liečbou roztrúsenej sklerózy.
Na začiatku liečby sa zvyčajne odporúča titrovať dávku. Liečba sa má začať podávaním 0,0625 mg (0,25 ml) subkutánne každý druhý deň s postupným zvyšovaním dávky na 0,250 mg (1,0 ml), ktorá sa tiež podáva každý druhý deň. Obdobie titrácie dávky sa môže zmeniť v prípade akejkoľvek významnej nežiaducej reakcie. Na dosiahnutie dostatočnej účinnosti terapie sa má podávať dávka 0,250 mg (1,0 ml) každý druhý deň.
Tabuľka pre titráciu dávky:
V klinických štúdiách dosiahlo trvanie liečby u pacientov s relaps-remitujúcou a sekundárne progresívnou roztrúsenou sklerózou 5 rokov a 3 roky.
Pri relaps-remitujúcej skleróze multiplex bola účinnosť liečby Betaferonom preukázaná počas prvých dvoch rokov liečby. Dostupné údaje pre ďalšie 3 letné obdobie liečby sú v súlade s údajmi o účinnosti liečby Betaferonom počas celého obdobia liečby.
U pacientov s klinicky izolovaným syndrómom naznačujúcim roztrúsenú sklerózu bola progresia ochorenia do CRMS oneskorená o 5 rokov.
Liečba Betaferonom sa neodporúča u pacientov s relaps-remitujúcou roztrúsenou sklerózou, ktorí mali menej ako dva relapsy za posledné 2 roky, a u pacientov so sekundárne progresívnou roztrúsenou sklerózou, u ktorých sa nevyskytla aktívna fáza ochorenie za posledné 2 roky.
Liečba Betaferonom sa má prerušiť, ak pacient neodpovedá na liečbu, napríklad ak dôjde k stabilnej progresii ochorenia v priebehu 6 mesiacov na stupnici EDSS (rozšírená stupnica postihnutia) alebo napriek liečbe Betaferonom najmenej tri cykly liečby Vyžaduje sa liečba ACTH (adrenokortikotropný hormón) alebo kortikosteroidy počas 1 roka.
Príprava injekčného roztoku
A. Balenie lieku obsahujúce injekčné liekovky a naplnené injekčné striekačky:
Na rozpustenie lyofilizovaného prášku interferónu beta-1b na injekciu použite dodanú hotovú injekčnú striekačku s rozpúšťadlom a ihlu.
B. Balenie lieku obsahujúce injekčné liekovky, naplnené injekčné striekačky, ihlový adaptér injekčnej liekovky a alkoholové tampóny:
Na rozpustenie lyofilizovaného prášku interferónu beta-1b na injekciu použite dodanú hotovú injekčnú striekačku s riedidlom a adaptér na injekčnú liekovku s ihlou.
1,2 ml rozpúšťadla (0,54 % roztok chloridu sodného) sa vstrekne do injekčnej liekovky s Betaferonom. Prášok by sa mal úplne rozpustiť bez pretrepávania. Pred použitím sa má skontrolovať hotový roztok, ktorý by mal byť mierne opaleskujúci až opalescentný, bezfarebný alebo svetložltý. V prípade prítomnosti častíc alebo zmeny farby roztoku sa nesmie použiť.
Nepoužitý roztok sa má zlikvidovať.
1 ml pripraveného roztoku obsahuje 0,25 mg (8 miliónov IU) interferónu beta-1b.
Množstvo liečiva potrebné v súlade s titrovanou dávkou sa natiahne do injekčnej striekačky po príprave roztoku.
Technika samoinjikovania pre pacientov
Na prípravu vlastnej injekcie a injekcie Betaferonu si pozorne prečítajte pokyny a postupujte podľa nich krok za krokom. Lekár alebo zdravotná sestra vás oboznámi s postupom a technikou samoinjikovania a pomôže vám naučiť sa. Nepokúšajte sa podať si injekciu, kým si nie ste istý, že ste správne pochopili požiadavky na prípravu roztoku, ako aj techniku samoinjikovania.
A. Balenie lieku obsahujúce injekčné liekovky a naplnené injekčné striekačky.
- Príprava na injekciu.
- Pridanie požadovaného objemu rozpúšťadla (1,2 ml) do injekčnej liekovky s Betaferonom.
- Nastavte požadovaný objem injekčného roztoku (1,0 ml) do injekčnej striekačky.
Príprava na injekciu
1. Pred podaním injekcie si pozbierajte všetko, čo na injekciu potrebujete.
Na to budete potrebovať:
- naplnená injekčná striekačka s riedidlom Betaferon (0,54 % roztok chloridu sodného)
- injekčná liekovka Betaferonu
- ihla 21G
- ihla 30G
- alkoholové obrúsky
- nádoba na použité injekčné striekačky a ihly
2. Dôkladne si umyte ruky mydlom.
3. Odstráňte ochranný kryt z injekčnej liekovky Betaferonu.
4. Utrite uzáver injekčnej liekovky Betaferonu alkoholovým tampónom (utrite jedným smerom a použite jednu utierku).
POZNÁMKA: Ponechajte alkoholový tampón na uzávere injekčnej liekovky a neodstraňujte ho, kým nebudete pripravený na použitie injekčnej liekovky.
Zavedenie požadovaného objemu rozpúšťadla (1,2 ml) do injekčnej liekovky s liekom Betaferon
POZNÁMKA: Vezmite injekčnú liekovku Betaferonu a zlikvidujte alkoholový tampón na vrchu.
1. Držte ruky na stabilnom povrchu a vyberte injekčnú striekačku s rozpúšťadlom z obalu. Potiahnutím uzáveru ho odstráňte zo základne injekčnej striekačky. Nedotýkajte sa otvoreného hrotu injekčnej striekačky. Netlačte na piest.
2. Vyberte ihlu 21G z obalu a pevne ju zasuňte do hrotu injekčnej striekačky. Odstráňte ochranný kryt z ihly. Nedotýkajte sa ihly.
3. S injekčnou liekovkou Betaferonu na stabilnom povrchu pomaly zasuňte ihlu injekčnej striekačky (obsahujúcej 1,2 ml rozpúšťadla) až na doraz cez zátku injekčnej liekovky.
4. Pomaly zatlačte na piest. Ihla by mala smerovať na stranu tak
tak, aby kvapalina stekala po stene injekčnej liekovky (ak do nej vstúpite priamo
prášok, potom sa vytvorí veľa peny).
5. Dbajte na to, aby sa ihla nedostala do kontaktu s práškom alebo výsledným materiálom
Riešenie.
6. Keď ste vstrekli celý obsah injekčnej striekačky do injekčnej liekovky Betaferonu, držte injekčnú liekovku medzi palcom, ukazovákom a prostredníkom tak, aby ihla a injekčná striekačka boli na vašom ramene.
7. Opatrne otáčajte injekčnou liekovkou v ruke, aby sa prášok Betaferonu úplne rozpustil. NETREPTE!
8. Starostlivo skontrolujte roztok (mal by byť priehľadný).
POZNÁMKA: Ak zmes obsahuje častice alebo zmenila farbu, vylejte ju a začnite celú procedúru od začiatku.
Súprava požadovaného objemu injekčného roztoku (1,0 ml) v injekčnej striekačke
POZNÁMKA: Pred natiahnutím pripraveného roztoku úplne stlačte piest injekčnej striekačky, aby ste odstránili všetok vzduch, ktorý mohol zostať v injekčnej striekačke.
1. Mierne nakloňte injekčnú liekovku s roztokom Betaferonu a vložte do nej hrot ihly
najnižší bod injekčnej liekovky.
POZNÁMKA: Uistite sa, že špičku ihly máte stále v roztoku.
2. Potiahnite piest a natiahnite 1,0 ml tekutiny do injekčnej striekačky až po značku.
3. Otočte injekčnú liekovku hore dnom a držte injekčnú striekačku ihlou nahor.
4. Jemne poklepte na injekčnú striekačku, aby sa do nej dostali vzduchové bubliny vyššia časť valec.
5. Jemne zatlačte na piest tak, aby zo striekačky vychádzal LEN VZDUCH.
6. Oddeľte injekčnú striekačku od ihly. Nechajte ihlu v injekčnej liekovke.
7. Položte injekčnú striekačku (bez ihly) na rovný povrch. Uistite sa, že hrot striekačky sa nedotýka povrchu.
8. Vezmite 30G ihlu, vyberte ju z obalu a pevne nasaďte na hrot injekčnej striekačky.
9. Zlikvidujte fľašu so zvyšným roztokom a ihlu.
Teraz ste pripravený na podanie injekcie.
B. Balenie lieku obsahujúce injekčné liekovky, naplnené injekčné striekačky, adaptér na injekčnú liekovku s ihlou a alkoholové tampóny.
Kroky prípravy roztoku:
1 - Pred začatím procedúry si dôkladne umyte ruky mydlom.
2 - Otvorte fľašu s Betaferonom - radšej nie nechtom, pretože sa môže zlomiť, ale palcom - a položte ju na stôl.

3 - Utrite uzáver injekčnej liekovky alkoholovým tampónom. Posuňte utierku iba jedným smerom a potom ju nechajte na uzávere injekčnej liekovky.

4 - Otvorte blistrové balenie obsahujúce adaptér na injekčnú liekovku, ale adaptér nechajte vo vnútri.
Neodstraňujte adaptér injekčnej liekovky z blistrabalenie.
Dávajte tiež pozor, aby ste sa nedotkli adaptéra injekčnej liekovky. Je dôležité, aby zostal sterilný.

5 - Pri pripájaní adaptéra držte injekčnú liekovku na rovnom povrchu.
6 - Odstráňte alkoholový tampón z uzáveru injekčnej liekovky Betaferonu. Umiestnite blistrové balenie obsahujúce zariadenie na prenos roztoku s adaptérom na injekčnú liekovku na uzáver injekčnej liekovky. Zatlačte na blister veľkým ukazovákov alebo dlaň, kým nezacvakne.

7 - Uchopte okraje blistrového balenia a vyberte ho z adaptéra na injekčnú liekovku. Teraz ste pripravený pripojiť naplnenú injekčnú striekačku s rozpúšťadlom k zariadeniu na prenos roztoku.

8 - Vezmite injekčnú striekačku. Otočte oranžový uzáver na hrote striekačky a stiahnite ho zo striekačky. Vyhoďte čiapku.

9 - Pripojte injekčnú striekačku k otvoru na boku adaptéra tak, že do nej vložíte hrot injekčnej striekačky a opatrne zaistite stlačením a otáčaním v smere hodinových ručičiek (ako je znázornené šípkou), aby ste vytvorili zostavu s injekčnou striekačkou.

10 - Držte súpravu s injekčnou striekačkou na dne injekčnej liekovky. Pomaly zatlačte piest injekčnej striekačky úplne nadol, aby sa celé rozpúšťadlo presunulo do injekčnej liekovky. Uvoľnite piest. V tomto prípade sa piest môže vrátiť do svojej pôvodnej polohy.

11 - Urobte niekoľko jemných rotačných pohybov s fľašou, aby sa suchý prášok Betaferonu úplne rozpustil. V tomto prípade zostáva dizajn s injekčnou striekačkou stále pripojený k injekčnej liekovke.
Injekčnou liekovkou netraste.

12 - Starostlivo skontrolujte roztok. Mal by byť priehľadný a nemal by obsahovať žiadne častice. Ak
roztok zmenil farbu alebo obsahuje častice, vylejte ho a začnite celý postup od začiatku, pričom si vezmite nový balík príslušenstva. Ak sa objaví pena - čo sa môže stať, ak sa injekčnou liekovkou zatrasie resp
príliš otáčajte - nechajte fľašu stáť, kým sa pena neusadí.
Príprava injekčnej striekačky

13 - Ak sa piest vrátil do svojej pôvodnej polohy, znova ho zatlačte a zaistite. Na prípravu injekcie otočte súpravu tak, aby bola injekčná liekovka navrchu a uzáver injekčnej liekovky smeroval nadol. To umožní, aby roztok vytiekol do injekčnej striekačky.
Držte injekčnú striekačku vodorovne.
Pomalým potiahnutím piestu natiahnite všetok roztok z injekčnej liekovky do injekčnej striekačky.
14 - Otočte zostavu injekčnej striekačky tak, aby ihla smerovala nahor. To spôsobí, že na povrch roztoku stúpajú vzduchové bubliny.

15 - Odstráňte vzduchové bubliny jemným poklepaním na injekčnú striekačku a posunutím piestu po značku 1 ml alebo viac.
množstvo predpísané lekárom.
Ak sa do injekčnej liekovky vtlačilo príliš veľa roztoku spolu so vzduchovými bublinami, potiahnite piest trochu dozadu, aby ste natiahli roztok z injekčnej liekovky späť do injekčnej striekačky. Robte to dovtedy, kým sa neodstráni všetok vzduch a injekčná striekačka nebude obsahovať 1 ml pripraveného roztoku.
Dôležitá poznámka : Pri opätovnom odbere roztoku vráťte zostavu injekčnej striekačky do vodorovnej polohy, v ktorej je injekčná liekovka navrchu.

16 - Potom uchopte modrý adaptér injekčnej liekovky spolu s injekčnou liekovkou pripojenou k nemu,
otočte adaptér smerom k sebe a potom ho oddeľte od injekčnej striekačky.
Pri oddeľovaní adaptéra injekčnej liekovky od injekčnej striekačky uchopte iba modrý plastový adaptér. Držte injekčnú striekačku vo vodorovnej polohe; injekčná liekovka by mala byť pod injekčnou striekačkou.

17 - V dôsledku odpojenia injekčnej liekovky a adaptéra od injekčnej striekačky roztok vyteká z ihly počas injekcie.
18 - Teraz ste pripravený na podanie injekcie.
POZNÁMKA: Liek sa má podať subkutánne ihneď po príprave roztoku. Ak sa injekcia oneskorí, roztok sa má uchovávať v chladničke a použiť do 3 hodín Roztok sa nesmie zmraziť.
19 - Zlikvidujte injekčnú liekovku a zvyšný nepoužitý roztok do nádoby na
mrhať.
Stručný opis príprava lieku na injekciu
1. Vyberte obsah z balenia.
2. Nasaďte adaptér na injekčnú liekovku.
3. Pripojte injekčnú striekačku k adaptéru injekčnej liekovky.
4. Zatlačením piestu presuňte rozpúšťadlo do injekčnej liekovky.
5. Otočte zostavu injekčnej striekačky a potom potiahnite piest späť.
6. Oddeľte injekčnú liekovku od injekčnej striekačky – teraz ste pripravený na podanie injekcie.
POZNÁMKA: Liek sa má podať subkutánne ihneď po príprave roztoku. Ak sa injekcia oneskorí, roztok sa má uchovávať v chladničke a použiť do 3 hodín Roztok sa nesmie zmraziť.
Výber a príprava miesta vpichu a podávanie roztoku liečiva
Betaferon (1,0 ml) subkutánne
- Výber miesta vpichu
Betaferon (interferón beta-1b) sa má podávať subkutánne. Na to sú najvhodnejšie mäkké miesta vzdialené od kĺbov a nervov.
Miesta vpichu je možné vybrať pomocou výkresu. Najlepšie je najprv určiť miesto vpichu a potom pripraviť injekčnú striekačku.
Ak je pre vás ťažké dostať sa na akékoľvek miesto, požiadajte o pomoc niekoho, kto vie, ako podávať injekcie.
1 - Vyberte miesto vpichu (pozri obrázok „Striedavé injekcie“ na konci návodu).
DÔLEŽITÁ POZNÁMKA: Nepodávajte injekciu do oblastí, kde sú hrčky, opuchy, tvrdé uzly alebo bolesť. Okrem toho sa roztok nemá podávať do tých oblastí, kde sú zmeny farby kože, priehlbiny, chrasty alebo je porušená celistvosť kože. Ak spozorujete tieto alebo iné nezvyčajné stavy, kontaktujte svojho poskytovateľa zdravotnej starostlivosti.
2 - Utrite kožu v mieste vpichu tampónom napusteným alkoholom a nechajte pokožku na vzduchu vyschnúť. Obrúsok vyhoďte.
Na dezinfekciu pokožky použite vhodný dezinfekčný prostriedok.

3 - Odstráňte ochranný kryt z ihly. Uzáver namiesto otáčania potiahnite.
4 - Jemne uchopte pokožku okolo dezinfikovanej oblasti (aby ste ju trochu nadvihli).

5 - Vpichnite ihlu priamo do kože pod 90° uhlom ostrým a istým pohybom. Striekačku držte ako ceruzku resp
šípka.
6 - Pomaly vstreknite roztok, jemne a nepretržite stláčajte piest. (Stlačte piest až na doraz, kým nebude striekačka prázdna).
7- Vyhoďte injekčnú striekačku do odpadovej nádoby.
- Striedanie miest vpichu
Zakaždým sa musí vybrať nové miesto vpichu, pretože striedanie miest vpichu umožňuje hojenie kože a tiež pomáha predchádzať infekcii. Je lepšie vybrať miesto vpichu vopred a až potom pripraviť injekčnú striekačku. Schéma znázornená na obrázku vám pomôže správne striedať miesta vpichu. Ak ste si napríklad podali prvú injekciu do pravej polovice brucha, potom aplikujte druhú injekciu dovnútra ľavá polovica, tretí - v pravom stehne atď. podľa schémy, kým nepoužijete všetky možné miesta vpichu. Zaznamenajte si, kde a kedy ste si naposledy podali injekciu.


Podľa navrhovanej schémy sa po 8. injekcii (po 16 dňoch) vrátite na miesto prvej injekcie (napríklad na pravú stranu brucha). Toto sa nazýva „cyklus striedania“. V našom vzorovom diagrame je každá zóna rozdelená na 6 miest vpichu (spolu 48 miest vpichu): ľavé a pravé, horná, stredná a spodná časť príslušnej oblasti. Keď sa po jednom otočení vrátite do jednej zo zón, vyberte si najvzdialenejšie miesto vpichu v tejto zóne. Ak je niektorá oblasť bolestivá, prediskutujte ďalšie možné miesta vpichu so svojím lekárom.
Schéma prekladania:
Aby ste si pomohli správne striedať miesta vpichu, odporúča sa zapísať si, kedy a kde bola injekcia podaná. Na tento účel môžete použiť nasledujúcu schému prekladania:
1. cyklusstriedanie Prvých 8 injekcií sa podáva postupne z 1. zóny do 8. zóny, pričom sa použije iba ľavý horný segment každej zóny.
2. cyklusstriedanieĎalších 8 injekcií začne znova od 1. zóny, ale je potrebné ich vykonať v pravom dolnom segmente každej zóny.
3. cyklusstriedanieĎalších 8 injekcií v tomto cykle začína od 1. zóny a vykonáva sa postupne v centrálnych ľavých segmentoch každej zóny.
Ak dodržíte túto postupnosť, každá zóna bude mať možnosť úplne sa zotaviť pred ďalšou injekciou.
Registrácia vykonaných injekcií
Pokyny na zaznamenávanie miest a dátumov vykonaných injekcií
Vyberte miesto vpichu. Ak už používate Betaferon, tak začnite so zónou, ktorá nebola použitá počas posledného striedavého cyklu, t.j. za posledných 16 dní.
Po podaní injekcie si zapíšte použité miesto a dátum podania injekcie (pozri obrázok „Príklad zaznamenávania vykonaných injekcií“ na konci návodu na použitie).


VEDĽAJŠÍ ÚČINOK
Výskyt nežiaducich reakcií zvyčajne sprevádza začiatok liečby. Ich frekvencia sa časom znižuje.
Najčastejší komplex symptómov podobný chrípke (horúčka, zimnica, artralgia, celková nevoľnosť, potenie, bolesť hlavy alebo myalgia) sa môže vyskytnúť v dôsledku farmakologické pôsobenie liek Betaferon. Na začiatku liečby sa odporúča titrovať dávku. Závažnosť symptómov podobných chrípke možno znížiť užívaním nesteroidných protizápalových liekov.
U pacientov po zavedení lieku Betaferon v dávke 0,25 mg (8 miliónov IU) sa často vyskytujú reakcie v mieste vpichu injekcie (napríklad sčervenanie, opuch, zmena farby kože, zápal, bolesť, precitlivenosť, nekróza a špecifické reakcie).
Frekvencia reakcií v mieste vpichu môže byť znížená použitím zariadenia na automatické podávanie lieku.
Nežiaduce reakcie (AR) pri použití lieku Betaferon, pozorované v priebehu klinických štúdií a identifikované v procese pozorovania po registrácii, a frekvencia ich výskytu sú uvedené nižšie.
Na opis špecifickej reakcie, jej synoným a súvisiacich stavov sa používa najvhodnejší výraz z lekárskeho slovníka pre regulačné činnosti (MedDRA).
Stôl 1: Nežiaduce udalosti a odchýlky laboratórnych parametrov, pozorované počas Klinické štúdie s mierou výskytu ≥ 10 % a syndrómom zahŕňajúcim aspoň dve z nasledujúcich nežiaducich udalostí:
horúčka, zimnica, myalgia, nevoľnosť a potenie;
3 - odchýlka od normy laboratórnych parametrov;
4
Betaferon u pacientov s klinicky izolovaným syndrómom, ktorý umožňuje
naznačujú sklerózu multiplex, s< 0,05;
5
- nežiaduce udalosti, väčšinou spojené s užívaním lieku
Betaferon u pacientov s relaps-remitujúcou roztrúsenou sklerózou,
p< 0,05;
6
- nežiaduce udalosti, väčšinou spojené s užívaním lieku
Betaferon u pacientov so sekundárne progresívnou roztrúsenou sklerózou, s< 0,05;
7
- počas klinickej štúdie BENEFIT neboli pozorované žiadne zmeny v profile
bezpečnosť Betaferonu.
Tabuľka 2: Nežiaduce reakcie zistené počas pozorovaní po registrácii, pre ktoré je stanovená frekvencia výskytu, sa určujú na základe súhrnných údajov z klinických štúdií (
3 - vzťahuje sa na všetky prípravky obsahujúce interferón (pozri nižšie).
Betaferon je liek používaný na liečbu roztrúsenej sklerózy.
Forma a zloženie uvoľnenia
Betaferon sa vyrába vo forme bieleho lyofilizátu, s priehľadným bezfarebným rozpúšťadlom pripojeným v súprave, v 9,6 milióna IU sklenených injekčných liekovkách a 1,2 injekčných striekačkách. Hotový roztok má vzhľad mierne opaleskujúcej svetložltej alebo bezfarebnej kvapaliny.
Jedna fľaša Betaferonu obsahuje 9,6 milióna IU rekombinantného interferónu beta-1b a nasledujúce pomocné látky – manitol a ľudský albumín. Zloženie rozpúšťadla zahŕňa sterilný 0,54% roztok chloridu sodného.
Indikácie na použitie
V súlade s pokynmi je Betaferon predpísaný na liečbu klinicky izolovaného syndrómu, ktorý znižuje závažnosť exacerbácie a frekvenciu relaps-remitujúcej roztrúsenej sklerózy a sekundárne progresívnej roztrúsenej sklerózy.
Kontraindikácie
Použitie Betaferonu je kontraindikované počas tehotenstva, ako aj v prípadoch precitlivenosti pacienta na ktorúkoľvek zložku lieku a počas obdobia dojčenia.
S opatrnosťou sa liek predpisuje na poruchy funkcie pečene, anamnézu epileptických záchvatov, srdcové choroby, anémiu, depresiu, trombocytopéniu, samovražedné myšlienky, ako aj pacientov mladších ako 18 rokov.
Spôsob aplikácie a dávkovanie
Liek sa podáva subkutánne pod dohľadom lekára. Dávka činidla je 250 mcg, čo zodpovedá 1 ml hotového roztoku. Injekcie sa podávajú prísne raz za 48 hodín.Dĺžku liečby Betaferonom určuje lekár v individuálne a môže trvať 3 až 5 rokov.
Vedľajšie účinky
Pri použití môže Betaferon spôsobiť vedľajšie účinky niektorých systémov tela, a to:
- Arteriálna hypertenzia, tachykardia, vazodilatácia, kardiomyopatia a palpitácie (kardiovaskulárny systém);
- Bolesť brucha, nevoľnosť, pankreatitída, vracanie, zvýšená aktivita aspartátaminotransferázy a alanínaminotransferázy, hepatitída a hnačka (tráviaci systém);
- Lymfocytopénia, anémia, neutropénia, leukopénia, trombocytopénia a lymfadenopatia (hematopoetický systém);
- Myasthenia gravis, artralgia, myalgia a kŕče v nohách (muskuloskeletálny systém);
- Dýchavičnosť a bronchospazmus (dýchací systém);
- Naliehavé nutkanie na močenie (močový systém);
- Metrorágia, menorágia, menštruačné poruchy a impotencia (reprodukčný systém);
- Zhoršená funkcia štítna žľaza, hypertyreóza a hypotyreóza (endokrinný systém);
- Zvýšené hladiny triglyceridov (metabolizmus).
Tiež podľa pokynov Betaferon spôsobuje nasledujúce vedľajšie účinky a reakcie:
- nespavosť, závraty, svalová hypertonicita anorexia, pokusy o samovraždu, depresia, nepokoj, zmätenosť, emočná labilita a nekoordinovanosť (centrálny nervový systém);
- Anafylaktické reakcie ( alergické reakcie);
- Hyperémia, lokálny edém, zápal, bolesť a nekróza v mieste vpichu (lokálne reakcie);
- Alopécia, žihľavka, vyrážka, svrbenie a zmena farby kože (dermatologické reakcie);
- Asténia, bolesť hlavy, celková nevoľnosť, horúčka, bolesť brucha a hrudníka, triaška a symptómy podobné chrípke (telo ako celok).
špeciálne pokyny
Bezprostredne pred začiatkom liečby, ako aj pravidelne počas celého obdobia užívania Betaferonu sa odporúča vykonať podrobný krvný test a sledovať funkciu pečene. V prípadoch, keď sa zistí významné zvýšenie pečeňových transamináz, sa liek musí prerušiť.
Je dôležité informovať pacientov, že Betaferon môže spôsobiť vedľajšie účinky, ako sú samovražedné myšlienky a depresia.
Liek spôsobuje nežiaduce účinky z centrálneho nervového systému, preto by pacienti mali byť pri podávaní opatrní zložité mechanizmy a vozidlá.
Liečivo v zriedenom stave sa má použiť okamžite.
Analógy
Synonymom pre liek je liek Betfer-1B. Analógy Betaferonu sú lieky ako:
- Alfarekin;
- Bioferon;
- virogel;
- Genfaxon;
- Ingaron;
- laferobion;
- nazoferon;
- pegintron;
- Realdiron;
- ceferón;
- Eberon Alpha R;
- Unitron.
Podmienky skladovania
Betaferon sa má podľa návodu skladovať v suchu, mimo dosahu detí a svetla, pri teplote 15-25°C.
Liek sa uvoľňuje z lekární na lekársky predpis. Čas použiteľnosti lieku je dva roky. Po dátume exspirácie sa liek musí zlikvidovať. Rozpúšťadlo sa skladuje tri roky.
Betaferon- prvý liek vyvinutý špeciálne na liečbu sklerózy multiplex a registrovaný len pre túto indikáciu.
Pri relapsujúcej aj sekundárne progresívnej skleróze multiplex liečba Betaferonom znižuje frekvenciu (o 30 %) a závažnosť klinických exacerbácií ochorenia, počet hospitalizácií a potrebu liečby glukokortikosteroidmi a tiež predlžuje trvanie remisie.
U pacientov so sekundárne progresívnou SM môže liečba Betaferonom oddialiť ďalšiu progresiu ochorenia a nástup invalidity, vrátane ťažkej (t. j. keď sú pacienti nútení neustále používať invalidný vozík) až na 12 mesiacov. Tento účinok sa pozoruje u pacientov s exacerbáciami ochorenia aj bez exacerbácií, ako aj s akýmkoľvek indexom invalidity (na štúdii sa zúčastnili pacienti so skóre 3,0 až 6,5 bodu na rozšírenej škále hodnotenia stavu invalidity).
Výsledky magnetickej rezonancie mozgu pacientov s recidivujúcou a sekundárne progresívnou roztrúsenou sklerózou počas liečby Betaferonom potvrdzujú významný pozitívny účinok lieku na závažnosť patologického procesu, ako aj významný pokles tvorby nových aktívnych ohniská.
Farmakologické vlastnosti
Farmakodynamika. Účinná látka lieku Betaferon (interferón beta-lb) má antivírusovú a imunomodulačnú aktivitu. Mechanizmy účinku interferónu beta-1b pri roztrúsenej skleróze (MS) neboli úplne stanovené. Je však známe, že biologický účinok interferónu beta-1b je sprostredkovaný jeho interakciou so špecifickými receptormi nachádzajúcimi sa na povrchu ľudských buniek. Väzba interferónu beta-1K na tieto receptory vyvoláva expresiu množstva látok, ktoré sa považujú za mediátory biologických účinkov interferónu beta-1K Návod na použitie: niektoré z týchto látok boli stanovené v sére a frakciách krvných buniek pacientov liečených interferónom beta-1K. schopnosť receptora interferónu gama a zvyšuje jeho internalizáciu a degradáciu. Okrem toho interferón beta-1b zvyšuje supresorovú aktivitu mononukleárnych buniek periférnej krvi.
Štúdie akútnej toxicity sa neuskutočnili. Keďže hlodavce nie sú citlivé na účinky ľudského interferónu beta, hodnotenie rizika bolo založené na štúdiách toxicity po opakovanom podávaní u opíc rhesus. Pozorovala sa prechodná hypertermia spolu s výrazným prechodným zvýšením koncentrácie lymfocytov a prechodným znížením počtu krvných doštičiek a segmentovaných neutrofilov.
Dlhodobé štúdie toxicity sa neuskutočnili. Štúdie reprodukčnej toxicity u opíc rhesus preukázali materskú toxicitu a zvýšenie miery spontánnych potratov. U živých potomkov neboli pozorované žiadne malformácie. Štúdie účinku na fertilitu sa neuskutočnili. Nebol pozorovaný žiadny vplyv na estrálny cyklus opíc.
V jednej samostatnej štúdii genotoxicity (Amesov test) neboli pozorované žiadne mutagénne účinky. Štúdie karcinogenity sa neuskutočnili. Test bunkovej transformácie in vitro neodhalil žiadny karcinogénny potenciál.
Farmakokinetika. Po subkutánnom podaní Betaferonu v odporúčanej dávke 0,25 mg sú sérové koncentrácie interferónu beta-1b nízke alebo sa vôbec nezistili. V tejto súvislosti neexistujú žiadne informácie o farmakokinetike lieku u pacientov so sklerózou multiplex, ktorí dostávajú Betaferon v odporúčanej dávke. Po subkutánnom podaní 0,5 mg Betaferonu sa maximálna plazmatická koncentrácia dosiahne 1-8 hodín po injekcii a je približne 40 IU/ml. Absolútna biologická dostupnosť Betaferonu pri subkutánnom podaní je približne 50 %. Pri intravenóznom podaní interferónu beta-1b je klírens a polčas liečiva zo séra v priemere 30 ml / min / kg a 5 hodín.
Zavedenie Betaferonu každý druhý deň nevedie k zvýšeniu koncentrácie interferónu beta-lb v krvnej plazme a jeho farmakokinetika sa v priebehu liečby nemení.
Pri subkutánnej aplikácii Betaferonu v dávke 0,25 mg každý druhý deň Návod na použitie: Markery biologickej odpovede (neopterín, beta2-mikroglobulín a imunosupresívny cytokín, interleukín-10) sa výrazne zvyšujú v porovnaní s východiskovými hodnotami 6-12 hodín po prvom dávka lieku. Vrchol dosiahli po 40-124 hodinách a zostali zvýšené počas 7-dňového (168-hodinového) obdobia štúdie.
Indikácie pre použitie Betaferonu
Klinicky izolovaný syndróm (CIS) (jediná klinická epizóda demyelinizácie naznačujúca roztrúsenú sklerózu, za predpokladu, že sú vylúčené alternatívne diagnózy) s dostatočným zápalom, ktorý si vyžaduje intravenózne kortikosteroidy na spomalenie progresie do klinicky významnej roztrúsenej sklerózy (CRMS) u vysokorizikových pacientov KDRS.
Neexistuje všeobecne akceptovaná definícia vysokého rizika. Podľa štúdie pacienti s monofokálnym CIS (klinické prejavy 1 lézie v CNS) a > 9 T2 ložiskami na MRI a/alebo ložiskami akumulujúcimi kontrastnú látku patria do skupiny s vysokým rizikom vzniku CRMS. Pacienti s multifokálnym CIS (klinické prejavy >1 lézie v CNS) majú vysoké riziko vzniku CRMS bez ohľadu na počet ložísk na MRI.
Relaps-remitujúca roztrúsená skleróza (RRMS) - na zníženie frekvencie a závažnosti exacerbácií u ambulantných pacientov (t. j. pacientov schopných chodiť bez pomoci) s anamnézou najmenej 2 exacerbácií za posledné 2 roky, po ktorých nasleduje úplné alebo neúplné uzdravenie neurologického ochorenia. deficitu.
Sekundárne progresívna roztrúsená skleróza s aktívnym priebehom ochorenia, charakterizovaná exacerbáciami alebo závažným zhoršením neurologických funkcií za posledné dva roky - na zníženie frekvencie a závažnosti klinických exacerbácií ochorenia, ako aj na spomalenie rýchlosti progresie choroba
Dávkovanie a podávanie
Liečba Betaferonom sa má začať pod dohľadom lekára, ktorý má skúsenosti s liečbou roztrúsenej sklerózy. V súčasnosti zostáva nevyriešená otázka dĺžky liečby Betaferonom. V klinických štúdiách trvanie liečby u pacientov s relaps-remitujúcou a sekundárne progresívnou roztrúsenou sklerózou dosiahlo 5 a 3 roky. Trvanie kurzu určuje lekár.
Príprava injekčného roztoku
A. Balenie lieku obsahujúce injekčné liekovky a naplnené injekčné striekačky: Na rozpustenie lyofilizovaného prášku na injekciu interferónu beta-1b použite pribalenú injekčnú striekačku s rozpúšťadlom a ihlu.
B. Balenie produktu obsahujúce injekčné liekovky, naplnené injekčné striekačky, adaptér injekčnej liekovky s ihlou a alkoholové tampóny: Na rozpustenie lyofilizovaného prášku na injekciu interferónu beta-1b použite pribalenú injekčnú striekačku s rozpúšťadlom a adaptér injekčnej liekovky s ihlou.
1,2 ml rozpúšťadla (0,54 % roztok chloridu sodného) sa vstrekne do fľaše s Betaferonom. Prášok by sa mal úplne rozpustiť bez pretrepávania. Pred použitím skontrolujte hotový roztok. V prípade prítomnosti častíc alebo zmeny farby roztoku sa nesmie použiť. 1 ml pripraveného roztoku obsahuje 0,25 mg (8 miliónov IU) interferónu beta-lb.
Odporúčaná dávka Betaferonu 0,25 mg (8 miliónov IU), ktorá je obsiahnutá v 1 ml pripraveného roztoku, sa podáva subkutánne každý druhý deň. Ak ste si zabudli podať injekciu v plánovanom čase, musíte si podať injekciu lieku hneď, ako si na to spomeniete. Ďalšia injekcia sa podá po 48 hodinách.
Funkcie aplikácie
Tento liek obsahuje ľudský albumín, a preto je riziko prenosu veľmi nízke vírusové ochorenia. Teoretické riziko prenosu Creutzfeldt-Jakobovej choroby sa tiež považuje za vysoko nepravdepodobné.
Zmeny laboratórnych parametrov
Okrem štandardných laboratórnych testov predpísaných pri liečbe pacientov so sklerózou multiplex sa pred začatím liečby Betaferonom, ako aj pravidelne počas liečby, odporúča vykonať podrobný krvný test vrátane stanovenia počtu leukocytov, krvných doštičiek a biochemická analýza krvi a skontrolujte funkciu pečene (napr. aktivitu aspartátaminotransferázy (AST), alanínaminotransferázy (ALT) a gama-glutamyltransferázy (γ-GT)). Pri liečbe pacientov s anémiou, trombocytopéniou, leukopéniou (individuálne alebo v kombinácii) môže byť potrebné starostlivejšie sledovanie komplexného krvného obrazu vrátane stanovenia počtu červených krviniek, bielych krviniek, krvných doštičiek a vzorca leukocytov.
Gastrointestinálne poruchy
V zriedkavých prípadoch sa na pozadí používania Betaferonu pozoroval rozvoj pankreatitídy, vo väčšine prípadov spojený s prítomnosťou hypertriglyceridémie.
Poruchy pečene a žlčových ciest
Klinické štúdie ukázali, že liečba Betaferonom môže často viesť k asymptomatickému zvýšeniu aktivity „pečeňových“ transamináz, ktoré je vo väčšine prípadov mierne a prechodné. Tak ako pri iných interferónoch beta, ťažké lézie pečeň (vrátane zlyhanie pečene) pri používaní Betaferonu zriedkavo pozorované. Najzávažnejšie prípady boli hlásené u pacientov vystavených hepatotoxickým liekom alebo látkam, ako aj u niektorých komorbidity(napríklad zhubné nádory s metastázami, ťažké infekcie a sepsa, zneužívanie alkoholu).
Počas liečby Betaferonom je potrebné sledovať funkciu pečene (vrátane hodnotenia klinický obraz). Zvýšenie aktivity transamináz v krvnom sére si vyžaduje starostlivé sledovanie a vyšetrenie. Pri výraznom zvýšení aktivity transamináz v krvnom sére alebo objavení sa príznakov poškodenia pečene (napríklad žltačka) sa má liek vysadiť. S absenciou klinické príznaky poškodení pečene alebo po normalizácii aktivity „pečeňových“ enzýmov je možné obnoviť liečbu Betaferonom s monitorovaním funkcie pečene.
Endokrinné poruchy
Pacientom s dysfunkciou štítnej žľazy sa odporúča pravidelne kontrolovať funkciu štítnej žľazy (hormóny štítnej žľazy, hormón stimulujúci štítnu žľazu) av iných prípadoch - podľa klinických indikácií.
Choroby kardiovaskulárneho systému
Betaferon sa má používať s opatrnosťou u pacientov so srdcovým ochorením, najmä so srdcovým zlyhaním v štádiu III-IV podľa klasifikácie New York Heart Association (NYHA), keďže takíto pacienti neboli zaradení do klinických štúdií. Ak sa počas liečby Betaferonom rozvinie kardiomyopatia a predpokladá sa, že je to spôsobené užívaním lieku, liečba Betaferonom sa má prerušiť.
Choroby nervového systému
Pacienti majú byť informovaní, že vedľajším účinkom Betaferonu môže byť depresia a samovražedné myšlienky, pri ktorých výskyte by sa mal okamžite poradiť s lekárom. V dvoch kontrolovaných klinických štúdiách zahŕňajúcich 1 657 pacientov so sekundárne progresívnou SM neboli žiadne významné rozdiely vo výskyte depresie a samovražedných myšlienok pri použití Betaferonu alebo placeba. Pri predpisovaní Betaferonu pacientom je však potrebná opatrnosť depresívnych porúch a história samovražedných myšlienok. Ak sa takéto javy vyskytnú počas liečby, treba zvážiť otázku vhodnosti vysadenia Betaferonu. Betaferon sa má používať s opatrnosťou u pacientov s anamnézou záchvatov.
Celkové poruchy a poruchy v mieste vpichu
Môžu sa vyskytnúť závažné alergické reakcie (zriedkavé, ale akútne a závažné, ako je bronchospazmus, anafylaxia a urtikária). Ak sa objavia známky poškodenia celistvosti kože (napríklad odtok tekutiny z miesta vpichu), pacient sa má pred pokračovaním v podávaní injekcií Betaferonu poradiť s lekárom. U pacientov užívajúcich Betaferon sa pozorovali prípady nekrózy v mieste vpichu injekcie (pozri „Vedľajšie účinky“). Nekróza môže byť rozsiahla a môže sa rozšíriť do svalovej fascie, ako aj do tukového tkaniva a následne viesť k zjazveniu. V niektorých prípadoch je potrebné odstránenie odumretej kože alebo menej často transplantácia kože. Proces hojenia môže trvať až 6 mesiacov.
Keď sa objavia viaceré ložiská nekrózy, liečba Betaferonom sa má prerušiť až do úplného zahojenia poškodených oblastí. V prípade jedného ohniska, ak nekróza nie je príliš rozsiahla, sa môže v používaní Betaferonu pokračovať, pretože u niektorých pacientov došlo k zahojeniu mŕtvej oblasti v mieste vpichu počas používania Betaferonu. Aby sa znížilo riziko vzniku reakcie a nekrózy v mieste vpichu, pacienti majú byť poučení, aby:
- vykonávať injekcie, prísne dodržiavať pravidlá aseptiky;
- zakaždým zmeňte miesto vpichu;
- vstreknite liek prísne subkutánne.
Pravidelne sa má kontrolovať správnosť samoinjikovania, najmä keď sa objavia lokálne reakcie.
Neutralizačné protilátky
Rovnako ako pri liečbe akýchkoľvek iných liekov s návodom na použitie: m proteín, pri použití Betaferonu existuje možnosť tvorby protilátok. V mnohých kontrolovaných klinických štúdiách sa každé 3 mesiace analyzovalo krvné sérum, aby sa zistila tvorba protilátok proti Betaferonu. V týchto štúdiách sa ukázalo, že neutralizačné protilátky proti interferónu beta-lb sa vytvorili u 23 % – 41 % pacientov, čo potvrdili minimálne dva následné pozitívne výsledky laboratórnych testov. U 43%-55% týchto pacientov, násled laboratórny výskum bola zistená stabilná absencia protilátok proti interferónu beta-lb.
V štúdii zahŕňajúcej pacientov s klinicky izolovaným syndrómom naznačujúcim roztrúsenú sklerózu sa neutralizačná aktivita, ktorá sa merala každých 6 mesiacov, pozorovala počas príslušných návštev u 16,5 – 25,2 % pacientov užívajúcich Betaferon. Neutralizačná aktivita bola zistená aspoň raz u 30 % (75) pacientov liečených Betaferonom; u 23 % (17) z nich sa pred ukončením štúdie stav protilátok opäť stal negatívnym. Počas dvojročného obdobia štúdie nebol rozvoj neutralizačnej aktivity spojený s poklesom klinickej účinnosti (v zmysle času do vzniku klinicky významnej sklerózy multiplex).
Nebolo dokázané, že by prítomnosť neutralizujúcich protilátok mala nejaký významný vplyv na klinické výsledky. Rozvoj neutralizačnej aktivity nebol spojený s objavením sa žiadnej Nežiaduce reakcie. Rozhodnutie o pokračovaní alebo ukončení liečby má byť založené na indikátoroch klinickej aktivity ochorenia, a nie na stave neutralizačnej aktivity.
poruchy imunity
Použitie cytokínov u pacientov s monoklonálnou gamapatiou bolo niekedy sprevádzané systémovým zvýšením permeability kapilár s rozvojom šoku a smrti.
Použitie u detí
Systematická štúdia účinnosti a bezpečnosti Betaferonu u detí a dospievajúcich mladších ako 18 rokov sa neuskutočnila.
Vplyv na schopnosť riadiť auto a pracovať s mechanizmami
Špeciálne štúdie neboli vykonané. Nežiaduce udalosti zo strany centrálneho nervového systému môžu ovplyvniť schopnosť viesť vozidlo a pracovať s mechanizmami. V tomto ohľade treba byť opatrný pri zapájaní sa do potenciálne nebezpečných činností, ktoré si vyžadujú zvýšenú pozornosť.
Vedľajšie účinky
Nasledujú nežiaduce udalosti pozorované s frekvenciou 2 % a vyššou ako v skupine s placebom (neaktívne liečivo) u pacientov, ktorí dostávali Betaferon v dávke 0,25 mg alebo 0,16 mg/m2 každý druhý deň až do troch rokov počas klinického skúšania. štúdia . Príznaky podobné chrípke možno zmierniť použitím nesteroidných protizápalových liekov. Skúsenosti s používaním Betaferonu na liečbu pacientov s roztrúsenou sklerózou sú dosť obmedzené, preto sa nežiaduce reakcie, ktoré sa vyskytujú s nízkou frekvenciou, ešte nemusia pozorovať. Na opis špecifickej reakcie, jej synoným a súvisiacich stavov sa používa najvhodnejší výraz z lekárskeho slovníka pre regulačné činnosti (MedDRA).
Celkové reakcie: Reakcia v mieste vpichu, asténia (slabosť), komplex symptómov podobných chrípke, bolesť hlavy, horúčka, triaška, periférny edém, bolesť na hrudníku, bolesť rôznej lokalizácie, celková nevoľnosť, nekróza v mieste vpichu.
Kardiovaskulárny systém: Posilnenie krvný tlak.
Tráviaci systém: Bolesť brucha.
Krv a lymfatický systém: Lymfocytopénia menej ako 1500/mm3, neutropénia menej ako 1500/mm3, leukopénia menej ako 3000/mm3. Lymfadenopatia.
Poruchy metabolizmu a trávenia: Zvýšená aktivita enzýmov v krvi: aspartátaminotransferáza (AST) 5-krát od počiatočnej hodnoty, alanínaminotransferáza (ALT) 5-krát od počiatočnej hodnoty.
Muskuloskeletálny systém: Myasthenia gravis, myalgia, kŕče v nohách.
Nervový systém: Nespavosť, zhoršená koordinácia.
Dýchací systém: Dýchavičnosť.
Koža: Vyrážka, kožné lézie.
Urogenitálny systém: Nutkanie na močenie u žien - metrorágia (acyklická krvácanie z maternice), u mužov - impotencia.
Nižšie uvedený zoznam vedľajšie účinky na základe pozorovania používania Betaferonu po uvedení lieku na trh.
Celkové reakcie: Veľmi časté: príznaky podobné chrípke (horúčka, triaška, myalgia, bolesť hlavy alebo nadmerné potenie)*. Frekvencia týchto príznakov sa časom znižuje. Zriedkavé: celková nevoľnosť, bolesť na hrudníku, strata hmotnosti, prírastok hmotnosti.
Lokálne reakcie: Veľmi často: reakcie v mieste vpichu (hyperémia, lokálny edém), zápal, bolesť. Často: nekróza v mieste vpichu. V priebehu času, s pokračujúcou liečbou, frekvencia reakcií v mieste vpichu zvyčajne klesá.
Krv a lymfatický systém: Menej často: anémia, trombocytopénia, leukopénia. Zriedkavé: lymfadenopatia.
Endokrinné poruchy: Zriedkavé: dysfunkcia štítnej žľazy vrátane hypertyreózy, hypotyreóza.
Metabolické poruchy: Zriedkavé: zvýšenie koncentrácie triglyceridov.
Nervový systém: Zriedkavo: svalová hypertonicita, depresia. Zriedkavé: kŕče, zmätenosť, nepokoj, emočná labilita, pokusy o samovraždu, anorexia, závraty.
Kardiovaskulárny systém: Zriedkavo: zvýšený krvný tlak. Zriedkavé: kardiomyopatia, tachykardia, silný tlkot srdca. Veľmi zriedkavé: vazodilatácia.
Dýchacie orgány: Zriedkavé: dýchavičnosť, bronchospazmus.
Gastrointestinálny trakt: Menej časté: nevoľnosť a vracanie. Zriedkavé: pankreatitída, hnačka.
Pečeň a žlčové cesty: Menej časté: zvýšená aktivita AST, ALT. Zriedkavé: zvýšená aktivita gama-glutamyltransferázy, koncentrácia bilirubínu, hepatitída.
Koža a podkožného tkaniva: Menej časté: alopécia, žihľavka, svrbenie kože, kožné vyrážky. Zriedkavé: zmena farby kože.
Kostrové svaly: Menej časté: myalgia. Zriedkavé: artralgia.
Ženský reprodukčný systém: Zriedkavé: menštruačné nepravidelnosti. Veľmi zriedkavé: menorágia (predĺžené menštruačné krvácanie).
Alergické reakcie: Zriedkavé: anafylaktické reakcie.
Interakcia s inými liekmi
Špeciálne štúdie interakcie Betaferonu s inými liekmi sa neuskutočnili. Účinok používania Betaferonu v dávke 0,25 mg (8 miliónov IU) každý druhý deň na metabolizmus lieky u pacientov so sklerózou multiplex nie je známy. Na pozadí používania Betaferonu sú glukokortikosteroidy a ACTH predpísané až na 28 dní pri liečbe exacerbácií dobre tolerované. Používanie Betaferonu súbežne s inými imunomodulátormi, okrem kortikosteroidov alebo ACTH, sa neskúmalo. Interferóny znižujú aktivitu pečeňových enzýmov závislých od cytochrómu P450 u ľudí a zvierat Pri predpisovaní Betaferonu v kombinácii s liekmi, ktoré majú úzky terapeutický index, ktorých klírens do značnej miery závisí od systému pečeňového cytochrómu P450 (napr. , antiepileptiká, antidepresíva) . Pozor si treba dať aj na súčasné užívanie akýchkoľvek liekov, ktoré ovplyvňujú hematopoetický systém. Vzhľadom na nedostatok štúdií kompatibility by sa tento liek nemal miešať s inými liekmi.
Kontraindikácie
- Tehotenstvo.
- Laktácia.
- Anamnéza reakcií z precitlivenosti na prirodzený alebo rekombinantný interferón-beta alebo ľudský albumín.
Betaferon sa má používať opatrne u pacientov s nasledujúcimi ochoreniami:
- srdcové choroby, najmä srdcové zlyhanie štádia III-IV podľa klasifikácie New York Heart Association (NYHA), kardiomyopatia;
- depresia a samovražedné myšlienky (vrátane anamnézy), epileptické záchvaty v anamnéze;
- monoklonálna gamapatia;
- anémia, trombocytopénia, leukopénia;
- dysfunkcia pečene.
Vzhľadom na nedostatok dostatočných skúseností s používaním je potrebná opatrnosť pri použití u pacientov mladších ako 18 rokov.
Tehotenstvo. Nie je známe, či Betaferon môže spôsobiť poškodenie plodu, keď sa lieči tehotným ženám, alebo či môže ovplyvniť ľudskú reprodukčnú funkciu. V kontrolovaných klinických štúdiách u pacientov so sklerózou multiplex sa vyskytli prípady spontánneho potratu. V štúdiách na opiciach rhesus mal ľudský interferón beta-I embryotoxický účinok a ďalšie vysoké dávky spôsobilo zvýšenie miery potratovosti. Ženy v reprodukčnom veku by mali počas užívania tohto lieku používať spoľahlivé metódy antikoncepcie. V prípade tehotenstva počas liečby Betaferonom alebo plánovania tehotenstva sa odporúča liek zrušiť.
Laktácia. Nie je známe, či sa interferón beta-1b vylučuje do materského mlieka. Vzhľadom na teoretickú možnosť vzniku nežiaducich reakcií na Betaferon u dojčiat, ktoré sú dojčené, je potrebné ukončiť dojčenie alebo prerušiť užívanie lieku.
Kontraindikované v tehotenstve (môže spôsobiť smrť plodu alebo spôsobiť vrodené malformácie). V čase liečby by ste mali prestať dojčiť.
Predávkovanie
Po zavedení Betaferonu intravenózne v dávke do 5,5 mg (176 miliónov IU) trikrát týždenne u dospelých pacientov s rakovinou sa nezistili žiadne závažné nežiaduce udalosti.
